Педиатрия-
“БРОНХИАЛЬНАЯ АСТМА У ДЕТЕЙ. СТРАТЕГИЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКА”
URL
Национальная программа
“Бронхиальная астма у детей. Стратегия лечения и профилактика”
создана по инициативе
Всероссийского научного общества пульмонологов
(председатель — академик РАМН, профессор А. Г. Чучалин)
и Союза педиатров России (председатель исполкома Союза — академик РАМН, профессор А. А. Баранов).
Координаторы программы:
проф. Геппе Н. А.,
проф. Каганов С. Ю.
РАБОЧАЯ ГРУППА ЭКСПЕРТОВ:
| БАЛАБОЛКИН И. И. | МОСКВА |
| ГАВАЛОВ С. М. | НОВОСИБИРСК |
| ГЕППЕ Н. А | МОСКВА |
| ЖАКОВ Я. И. | ЧЕЛЯБИНСК |
| КАГАНОВ С. Ю. | МОСКВА |
| КОРОСТОВЦЕВ Д. С. | САНКТ-ПЕТЕРБУРГ |
| ЛУКИНА О. Ф. | МОСКВА |
| МАКАРОВА И. В. | САНКТ-ПЕТЕРБУРГ |
| НЕРЕТИНА А. Ф. | ВОРОНЕЖ |
| ОГОРОДОВА Л.М. | ТОМСК |
| РЕВЯКИНА В. А. | МОСКВА |
| РЕЗНИК И. Б. | МОСКВА |
| ТЮРИН Н. А. | МОСКВА |
| ЯКУШЕНКО М. Н. | НАЛЬЧИК |
Помимо экспертов, материалы для разработки указанной национальной
программы представили:
академик РАМН, проф. Чучалин А. Г., проф. Ширяева И. С., проф.
Климанская Е. В., проф. Матвеева Л. А., проф. Святкина О. Б.,
проф. Ефимова А. А., проф. Богданова А. В., проф. Анохин М. И.,
проф. Фассахов Р. С., д.м.н. Розинова Н. Н., д.м.н. Айсанов З.
Р., д.м.н. Нисевич Л. Л., д.м.н. Дорохова Н. Ф,
д.м.н. Костинов М. П., д.м.н. Нестеренко В. Н., к.м.н. Мизерницкий
Ю. Л., к.м.н. Добрынина Е. Я., к.м.н. Дрожжев М. Е., к.м.н. Шемякина
Т. А., к.м.н. Чернова О. И., к.м.н. Лев Н.С., к.м.н. Елкина Т.
Н., к.м.н. Кондюрина Е. Г., врач Богорад А. Е., врач Сенкевич
Н. Ю.
Редакция “Русского Медицинского Журнала” выражает
признательность
компании “Рон-Пуленк-Рорер” за информационную и финансовую поддержку.
Введение
Бронхиальная астма принадлежит к числу распространенных аллергических
болезней в детском возрасте. За последние годы во всем мире, в
том числе и в России, отмечается тенденция к увеличению заболеваемости
бронхиальной астмой детей и ее более тяжелому течению. В связи
с этим проблема профилактики, диагностики и лечения этого заболевания приобретает первостепенное значение.
Достигнутый в настоящее время прогресс в изучении механизмов
развития бронхиальной астмы явился основой для разработки новой
концепции ее патогенеза, согласно которой основу астмы как заболевания
составляет аллергическое воспаление дыхательных путей и связанная
с ним гиперреактивность бронхов. Эта концепция предопределила
новую стратегию в терапии бронхиальной астмы, основанную на проведении
противовоспалительной терапии.
Современные подходы к лечению и профилактике бронхиальной
астмы нашли отражение в совместном докладе Всемирной организации
здравоохранения и Национального института здоровья США “Бронхиальная
астма. Глобальная стратегия” (1995). Основные положения этой инициативы
с учетом национальных подходов уже нашли практическое применение
во многих странах.
В настоящем издании на основе согласованной позиции педиатров,
работающих в области астмологии, с учетом исторически сложившихся
в России подходов и современного зарубежного опыта представлены
основные положения, касающиеся бронхиальной астмы у детей. Разработанная
Национальная программа “Бронхиальная астма у детей. Стратегия
лечения и профилактика” создана с учетом и на основе официального
доклада ВОЗ “Бронхиальная астма. Глобальная стратегия” (проект
GINA), рекомендаций международной педиатрической группы по астме
(1992 г.) и является первой в России утвержденной на национальном
конгрессе по болезням органов дыхания (Москва, 1997 г.) и рекомендованой
МЗ к использованию руководителям здравоохранения субъектов РФ
(№ 677У от 19.11.1997 г.).
Основная цель программы — внедрение в практическое здравоохранение
научно обоснованных унифицированных подходов к лечению и профилактике
бронхиальной астмы у детей. Важными задачами являются стандартизация
эпидемиологических исследований, разработка организационных мероприятий
по совершенствованию педиатрической помощи больным бронхиальной
астмой.
* * *
ГЛАВА I
ОПРЕДЕЛЕНИЕ БРОНХИАЛЬНОЙ АСТМЫ
КЛЮЧЕВЫЕ ПОЛОЖЕНИЯ:
|
Бронхиальная астма — это заболевание, которое начавшись у
детей, часто продолжается в зрелом возрасте, становясь причиной
инвалидности, а иногда и драматичных исходов. Бронхиальная астма
занимает высокий удельный вес среди аллергических заболеваний
у детей.
В клинической практике бронхиальную астму у детей часто не
диагностируют, диагноз подменяется понятием “астматический бронхит”,
“обструктивный синдром”, “обструктивный бронхит”, “астматический
компонент, “рецидивирующий обструктивный бронхит” и т.п. В отчете
о международном соглашении по диагностике и лечению бронхиальной
астмы ВОЗ и Национального института Сердце, Легкие, Кровь, справедливо
утверждается, что следует избегать у детей этих терминов, а использовать
правильный термин “бронхиальная астма”, чтобы оправданно разработать
стратегию противоастматической терапии.
Бронхиальная астма у детей раннего возраста в силу их анатомо-физиологических
особенностей имеет своеобразный клинический образ и представляет
значительные трудности как для диагностики, так и терапии. В клинической
практике диагноз бронхиальной астмы в этом возрасте устанавливают
не всегда своевременно.
Бронхиальная астма у детей 3-6 лет в определенной мере может
быть названа “переходной” — в части случаев заболевание в этом
возрасте несет черты, свойственные раннему детскому возрасту,
у других — приобретает отчетливые черты “взрослой” астмы.
Бронхиальная астма у детей старшего возраста во многом близка
к таковой у взрослых: по механизмам развития, клинической картине
и терапевтическим подходам.
Несвоевременно распознанная и рационально не леченная болезнь
прогрессирует, что в значительной мере ухудшает ее исход.
Существует также точка зрения, что при возникновении эпизодов
обструкции у ребенка более 3 раз в течение года следует подумать
о возможном дебюте бронхиальной астмы.
У детей иммунологический механизм развития заболевания является
основным. Правда, имеется точка зрения, что механизм развития
астмы может быть и неиммунологическим, и ее проявления могут возникать
под воздействием различных условий. Вопрос о неиммунологических
формах бронхиальной астмы у детей до настоящего времени является
предметом научных дискуссий. По мнению большинства исследователей,
неспецифические факторы, провоцирующие бронхиальную астму у детей,
всегда вторичны в том смысле, что их воздействию предшествуюет сенсибилизация организма и развитие
аллергического воспаления бронхов.
В классификации бронхиальной астмы у детей (принятой на симпозиуме
педиатров-пульмонологов в Москве в ноябре 1995) также подчеркивается, что нозологическую основу астмы составляют аллергическое воспаление дыхательных
путей и гиперреактивность бронхов.
В основе аллергических болезней, как сейчас установлено, лежат
повреждения, вызванные иммунной реакцией в ответ на воздействие.
В воспалительном процессе слизистой дыхательных путей участвуют
многие клетки, и он затрагивает все структуры стенки бронха: эпителиальный
покров, базальную мембрану, бронх-ассоциированную лимфоидную ткань,
сосуды, гладкие мышцы — и каждая из указанных структур
реагирует по-своему.
Комбинация различных компонентов воспаления вызывает комплекс
клинических проявлений, характерных для бронхиальной астмы. Развиваются
бронхоконстрикция, гиперсекреция слизи, отек слизистой оболочки
бронхов, формируется бронхиальная гиперреактивность.
Наследственное предрасположение — необходимое условие развития
атопической бронхиальной астмы.
Сейчас убедительно доказано, что клетки иммунной системы подвержены
модулирующим влияниям центральной нервной системы. Показано, что
у детей в период приступа бронхиальной астмы в крови отмечается
значительное повышение содержания субстанции Р — основного медиатора
нейрогенного воспаления и снижение других нейропептидов (в частности,
VIP), подавляющих высвобождение биологически активных веществ.
Морфологические данные при бронхиальной астме у детей также
свидетельствуют о серьезных изменениях бронхиального дерева —
повреждении мерцательного эпителия, увеличении количества эозинофинов,
тучных и бокаловидных клеток, пролиферации миофибробластов, отложении
коллагена в базальной мембране и ее утолщении, гипертрофии и гиперплазии
гладкой мускулатуры бронхов, отеке слизистой оболочки, склерозировании
подслизистого слоя и перибронхиальной ткани.
Прямым следствием воспалительного процесса является формирование
гиперчувствительности бронхов — повышенной их раздражимости и
способности к сокращению под действием специфических (аллергены)
и различных неспецифических (физическое и эмоциональное напряжение,
изменение метеоситуации) стимулов. Имеются также данные о том,
что бронхиальная гиперреактивность генетически детерминирована,
причем независимо от атопии.
Другим важнейшим патофизиологическим феноменом, лежащим в основе
бронхиальной астмы у детей, является бронхиальная обструкция,
которая носит диффузный характер и обусловливается известными
механизмами — спазмом гладкой мускулатуры бронхов, гиперсекрецией
слизи, отеком и инфильтрацией слизистой оболочки бронхов, их морфологической
перестройкой.
Определение бронхиальной астмы у детей:
Бронхиальная астма у детей — заболевание, развивающееся
на основе хронического аллергического воспаления бронхов, их гиперреактивности
и характеризующееся периодически возникающими приступами затрудненного
дыхания или удушья в результате распространенной бронхиальной
обструкции, обусловленной бронхоконстрикцией, гиперсекрецией слизи,
отеком стенки бронхов.
Эти принципиальные положения позволяют исключить разделение
астмы на аллергическую, инфекционно-аллергическую и смешанную
формы.
Данное современное определение бронхиальной астмы у детей,
должно способствовать более успешной ее диагностике, профилактике
и разработке патогенетической терапии, что улучшит прогноз заболевания.
| БРОНХИАЛЬНАЯ АСТМА у детей - заболевание, в основе которого лежит хроническое аллергическое воспаление бронхов, сопровождающееся их гиперреактивностью и периодически возникающими приступами затрудненного дыхания или удушья в результате распостраненной бронхиальной обструкции, обусловленной бронхоконстрикцией, гипесекрецией слизи, отеком стенки бронхов. Бронхиальная обструкция (под влиянием лечения или спонтанно) обратима. |
* * *
ГЛАВА II
ЭПИДЕМИОЛОГИЯ
КЛЮЧЕВЫЕ ПОЛОЖЕНИЯ:
|
2.1. РАСПРОСТРАНЕННОСТЬ
Эпидемиологические исследования последних лет свидетельствуют
о том, что от 4 до 8% населения страдают бронхиальной астмой.
В детской популяции этот процент повышается до 5-10%, во взрослой
— колеблется в пределах 5%. Распространенность астмы у детей варьирует
в различных странах и популяциях, однако среди хронической патологии
она, безусловно, является одной из самых частых. На показатели
распространенности существенным образом влияют определение астмы,
критерии ее диагностики, а также методика изучения.
Все статистические данные, как правило, базируются на показателях, полученных по обращаемости пациентов
в лечебные учреждения. Данные, полученные таким образом, не соответствуют
истинной распространенности заболевания, так как многие больные
не обращаются в медицинские учреждения по разным причинам, либо
врачи не устанавливают им диагноз астмы, особенно на ранних стадиях
болезни и в легких случаях.
К низким показателям распространенности астмы приводят также
отсутствие четких критериев диагностики и нерегистрирование болезни
из-за боязни ухудшить отчетные показатели, негативного отношения
родителей ребенка к установлению диагноза хронического заболевания
и т.д.
У некоторых больных, особенно с легким течением астмы, не устанавливается
правильный диагноз в периоде детства вообще, а у значительной части больных с астмой более тяжелого течения диагноз
устанавливается с опозданием на 2-6 лет от начала болезни. Проблемы
с диагностикой приводят к отсутствию или позднему началу профилактических
и лечебных мероприятий.
Распределение по степени тяжести больных астмой, выявленных
эпидемиологическими методами, выглядит следующим образом: 70%
— легкая степень, 25% — средняя и 5% — тяжелая и существенно отличается
от такового, по данным официальной медицинской статистики, где
легкие формы составляют около 20%, средней тяжести — 70%
и тяжелые — 10%.
Программа ISAAC
Наиболее надежные и сравнимые данные по распространенности
симптомов болезни во многих странах мира были получены за последние
годы в связи с внедрением и распространением программы ISAAC (International
Study of Asthma and Allergy in Childhood). В нашей стране первое
исследование, выполненное по опросникам ISAAC, было проведено
в г.Новосибирске (проф. С.М. Гавалов и соавт.) по инициативе академика
РАМН проф.А.Г.Чучалина и под патронажем проф. Д. Шарпена (Франция).
При анализе анкет оказалось, что на симптомы бронхиальной астмы
жаловались 23,4% детей в возрасте 13-14 лет, подобные симптомы
отмечали родители 27,8% первоклассников.При этом диагноз бронхиальной
астмы учреждениями практического здравоохранения был зафиксирован
только у 2,4% детей (у 3,3% восьмиклассников и 1,6% первоклассников).
По степени тяжести по результатам обследования восьмиклассников
бронхиальная астма легкой степени была выявлена у 80,4%, средней
степени тяжести — у 15%, тяжелая — у 4,6% детей с данной патологией.
Данные, полученные с использованием опросника ISAAC, на порядок
отличаются от официальной статистики не только в Новосибирске,
но и в других городах и районах области и приближаются, как в
отношении распространенности симптомов астмы, так и в оценке структуры
болезни по тяжести, к полученным в других странах.
При дальнейшем исследовании распространенности симптомов астмы,
ринита и экземы, включенным в программу ISAAC, рекомендуется использование
русскоязычной версии вопросника и единого програмного обеспечения,
что позволит в будущем оценивать данные, полученные в различных
регионах страны и в одном регионе в различное время, а также с
данными, полученными в других странах мира. В настоящее время
методика проведения исследования и анкеты публикуются в виде методического
письма.
Факторы, влияющие на распространенность
Причины реального увеличения распространенности астмы в детском возрасте не ясны. Связь астмы с бронхиальной гиперреактивностью и атопией и их связь со степенью загрязнения среды указывают на возможную роль урбанизации и индустриализации. Более высокая распространенность бронхиальной астмы у детей характерна для экологически неблагополучных промышленных районов.
2.2. КАЧЕСТВО ЖИЗНИ
Сама болезнь может вызывать стресс. Неадекватная медицинская
помощь усугубляет эти трудности. Однако, эмоциональные факторы
и ограничения в социальной сфере могут быть важнее неадекватно
контролируемых симптомов. Многие больные бронхиальной астмой не
полностью осознают влияние астмы на их социальную жизнь и заявляют,
что они ведут “нормальный” образ жизни. Это является следствием
того, что их понятие “нормальности”, возможно, основано на изменениях
и ограничениях, которые они уже включили в свой образ жизни или
из-за маскировки этих ограничений, желания “жить как все”.
Оценка качества жизни помогает врачу сосредоточить внимание
на позитивных аспектах жизни больного и способах их увеличения
(рис. 2-1).
Учет качества жизни пациентов может привести к улучшению качества
медицинского обслуживания в целом.
Основными методами определения качества жизни являются опросники.
Опросники, применяемые в педиатрической практике (рис. 2-2), разработаны с учетом психоэмоциональной сферы ребенка и в зависимости от возраста.
Они должны быть надежными, доступными пониманию и простыми в использовании.
2.3. СМЕРТНОСТЬ
По данным Санкт-Петербурга, в 1975-1984 гг. смертность в среднем
за год составила 0,075:100000 детского населения, а в 1985-1994
гг. — 0,2:100000.
Как показали многие эпидемиологические исследования, критическим
является препубертатный и пубертатный периоды, т.к. около 80%
смертей при бронхиальной астме приходится на возрастной интервал
11-16 лет. Летальный исход, как правило, наступает у больных с
тяжелой, длительно текущей бронхиальной астмой.
Непосредственной причиной смерти при бронхиальной астме у детей
является асфиктический синдром. Основная причина смертельного
исхода — это отсутствие адекватного лечения больных в период приступа,
отсутствие, недостаточное или позднее применение кортикостероидной
терапии. В немалой степени способствует летальному исходу недооценка
врачом тяжести состояния больного, отсутствие систематического
врачебного наблюдения, а также неадекватная оценка своего состояния
больным и его близкими, низкий социальный, а следовательно, культурный
и материальный уровень семьи больного. Согласно мнению большинства
клиницистов, основными факторами риска смерти при бронхиальной
астме являются тяжелое течение бронхиальной астмы, наличие указаний
в анамнезе на развитие экстремальных, жизнеопасных ситуаций вследствие
прогрессирующего приступа, необходимость интенсивной терапии или реанимационного пособия, проведение искусственной
вентиляции легких. Существенное значение также имеет внезапная
отмена или снижение дозы принимаемых гормональных препаратов в
течение последнего месяца, передозировка b2-агонистов и теофиллина (в частности, использование
для купирования приступа пролонгированных его форм), позднее назначение
кортикостероидов. Одним из факторов риска является отсутствие
четкого индивидуального плана лечения и клинических инструкций
по неотложной помощи у пациента-подростка или родителей больного
ребенка.
2.4. ВОЗРАСТНАЯ ЭВОЛЮЦИЯ БРОНХИАЛЬНОЙ АСТМЫ У ДЕТЕЙ
Длительное время существовало представление о том, что бронхиальная
астма у детей имеет в большинстве случаев благоприятное течение
и заканчивается спонтанным выздоровлением в пубертатном периоде.
В последние годы это мнение поколеблено. Проспективные и ретроспективные
исследования свидетельствуют о несомненной связи “детской” и “взрослой”
бронхиальной астмы. Считают, что бронхиальная астма, начавшаяся
в детстве, в 60-80% случаев продолжается у больных, достигших
зрелого возраста.
Исходы бронхиальной астмы определяются многими факторами, среди
которых главное значение придается тяжести заболевания. Освобождение
от приступов затрудненного дыхания отмечено, в основном, у больных
с легкой бронхиальной астмой. Нельзя, однако, не заметить, что
к понятию “выздоровление” при бронхиальной астме следует относиться
с большой осторожностью, так как выздоровление при бронхиальной
астме представляет по существу лишь длительную клиническую ремиссию,
которая может нарушиться под влиянием различных причин.
У больных бронхиальной астмой средней тяжести и особенно при
тяжелой бронхиальной астме исчезновение приступов удушья с возрастом
наблюдается редко, хотя у большинства из них удается добиться
улучшения.
Помимо тяжести бронхиальной астмы, на ее исход определенное
влияние оказывает отягощенная по аллергическим заболеваниям наследственность,
наличие у больного бронхиальной астмой других аллергических проявлений
(атопического дерматита, отека Квинке, пищевой и лекарственной
аллергии).
Весьма существенное значение для исходов бронхиальной астмы
у детей имеет адекватность и систематичность лечения. Своевременная
постановка диагноза, раннее разобщение больного с причинно-значимым
аллергеном, организация быта в значительной степени определяют
благоприятный исход заболевания, позволяют добиться улучшения
состояния больного ребенка.
ГЛАВА III ФАКТОРЫ РИСКА
Факторы повышенного риска смерти от бронхиальной астмы
- Тяжелое течение заболевания, с частыми рецидивами.
- Повторные астматические статусы в анамнезе; наличие в предшествующие 12 месяцев приступа, требовавшего реанимационного пособия.
- Врачебные ошибки:
- передозировка ингаляционных b2-агонистов,
- позднее назначение кортикостероидных препаратов,
- передозировка теофиллина,
- недооценка тяжести течения астмы,
- отсутствие или неэффективные схемы плановой терапии кортикостероидами,
- отсутствие письменных инструкций у больного и членов его семьи по неотложной терапии приступа. - Подростковый возраст больного.
- Низкий социальный, культурный, экономический уровень семьи.
3.1. ПРЕДРАСПОЛАГАЮЩИЕ ФАКТОРЫ
Наследственность
Риск возникновения астмы у ребенка от родителей, имеющих признаки атопии,
в 2-3 раза выше, чем у ребенка от родителей, ее не имеющих.
Описаны различные варианты наследования предрасположенности
к бронхиальной астме, однако ни один из них не нашел убедительных
подтверждений. В настоящее время преимущественным считают полигенное
наследование .
Предрасположенности к бронхиальной гиперреактивности и к атопии
наследуются независимо друг от друга, однако при их сочетании
значительно увеличивается риск развития бронхиальной астмы.
Таким образом, генетическая основа бронхиальной астмы представлена
комбинацией генетически независимых составляющих болезни: предрасположенности
к развитию атопии, к продукции
IgE-антител определенной специфичности и бронхиальной гиперреактивности.
Основные гены предрасположенности содержатся в хромосомах 5 и
11, причем особую роль играет кластер генов IL-4. Каждый из генетических
факторов предрасположенности повышает вероятность заболевания
астмой, а их комбинация приводит к высокому риску реализации заболевания
при минимальном участии факторов внешней среды.
Факторы риска возникновения бронхиальной астмы у детей
1. Факторы, предрасполагающие к развитию бронхиальной астмы:
Наследственность
Атопия
Гиперреактивность бронхов
2. Причинные (сенсибилизирующие) факторы:
- бытовые аллергены (домашняя пыль, клещи домашней пыли),
- аллергены животных, птиц, аллергены тараканов и других насекомых,
- грибковые аллергены,
- пыльцевые аллергены,
- пищевые аллергены,
- лекарственные средства,
- вирусы и вакцины,
- химические вещества.
3. Факторы, способствующие возникновению бронхиальной астмы, усугубляющие действие причинных факторов:
Вирусные респираторные инфекции
Патологическое течение беременности у матери ребенка
Недоношенность
Нерациональное питание
Атопический дерматит
Различные поллютанты
Табачный дым
4. Факторы, вызывающие обострение бронхиальной астмы — триггеры:
Аллергены
Вирусные респираторные инфекции
Физическая и психоэмоциональная нагрузка
Изменение метеоситуации
Экологические воздействия (ксенобиотики, табачный дым, резкие запахи)
Непереносимые продукты, лекарства.
Атопия
Атопия определяется как способность организма к выработке повышенного количества IgE в ответ на воздействие аллергенов окружающей среды и выявляется у 80-70% больных детей.
Гиперреактивность бронхов
В последние годы уделяется большое внимание гиперреактивности
бронхов у детей. Это состояние, выражающееся в повышенной реакции
бронхов на раздражитель, при котором бронхиальная обструкция развивается
в ответ на воздействие, не вызывающее такой реакции у большинства
здоровых лиц.
Бронхиальная гиперреактивность является универсальной характеристикой
бронхиальной астмы, степень ее коррелирует с тяжестью заболевания.
Имеются данные о генетической детерминированности бронхиальной
гиперреактивности.
3.2. ПРИЧИННЫЕ ФАКТОРЫ
Различные аллергены сенсибилизируют дыхательные пути, создавая
у предрасположенных лиц условия для развития аллергического воспаления
бронхов и клинической манифестации бронхиальной астмы.
Роль различных аллергенов в формировании бронхиальной астмы
у детей разного возраста неодинакова. Формирование различных видов
сенсибилизации у детей происходит в определенной временной последовательности.
Наиболее частой причиной возникновения бронхиальной астмы в возрасте до 1 года
является пищевая и лекарственная аллергия. У детей в возрасте
от 1 до 3 лет развитие бронхиальной астмы часто обусловлено бытовыми,
эпидермальными и грибковыми аллергенами; в возрасте старше 3-4
лет возрастает роль пыльцевой сенсибилизации. У детей, проживающих
в загрязненных промышленных районах, отмечают сенсибилизацию к
химическим веществам. В последнее время при бронхиальной астме
у детей возросла частота поливалентной сенсибилизации.
Бронхиальная астма, обусловленная пищевой сенсибилизацией,
характеризуется ранним началом, непрерывно рецидивирующим течением,
отсутствием связи приступов с сезонностью и пребыванием в неблагоприятной
домашней обстановке. У 92% этих детей наблюдаются сопутствующие
патологические нарушения со стороны желудочно-кишечного тракта.
У детей старшего возраста роль пищевой аллергии при бронхиальной
астме уменьшается, однако у детей с пыльцевой аллергией возможны
перекрестные реакции с пищевыми аллергенами.
Бытовые аллергены
Ведущую роль в формировании бытовой аллергии играют клещи домашней пыли, основными видами которых являются клещи-пироглифы Dermatophagoides pteronyssimus, Dermatophagoides farinae, Dermatophagoides microceras, Euroglyphus mainei, составляющие основную часть аллергенов домашней пыли. Аллергены клещей содержатся в их теле, секретах и экскретах. Много клещей содержится в коврах, драпировочных тканях, постельных принадлежностях, мягких игрушках и мягкой мебели, домашней обуви, под плинтусами. Наилучшими условиями для роста клеща являются температура 22-26°C и относительная влажность более 55%. По данным аллергологического обследования, сенсибилизация к D.pteronyssimus и D.farinae была выявлена у 73,5-91,0% детей с бронхиальной астмой. Клещевая бронхиальная астма характеризуется круглогодичным возникновением обострений, с учащением в весенне-осенний период и особенно в ночное время суток, когда наблюдается наибольшая экспозиция клещей домашней пыли.
Аллергены животного происхождения
Основными источниками этих аллергенов могут быть шерсть, пух,
перо, перхоть, экскременты, слюна разнообразных животных (кошек,
собак, морских свинок, хомячков и других грызунов, птиц, кроликов,
лошадей, овец и т.д.), а также насекомых (тараканов). Частым этиологическим
фактором бронхиальной астмы у детей является сухой корм (дафнии)
для аквариумных рыбок.
Даже после удаления животных высокий уровень аллергенов в доме
сохраняется в течение нескольких лет. Плохая вентиляция помещений
и скученность в квартирах способствуют накоплению аллергенов домашних
животных в квартире.
Аллергены тараканов являются в последнее время все более частой
причиной развития аллергических реакций.
Грибковые аллергены
Сенсибилизация к плесневым и дрожжевым грибам (Alternaria,
Aspergillus, Mucor, Candida, Penicillium, Cladosporium) выявляется
у 2/3 детей страдающих бронхиальной астмой. Грибы содержатся как
внутри помещений (в домашней пыли), так и во внешней среде.
Обострение болезни у детей с грибковой сенсибилизацией наблюдается
в осенне-зимний период, а иногда и круглогодично, при проживании
ребенка в сырых, плохо проветриваемых помещениях или при посещении
их. Для детей с грибковой бронхиальной астмой характерно тяжелое
ее течение с частыми рецидивами и короткими ремиссиями. Течение
грибковой бронхиальной астмы связано с особенностями распространения
грибов и концентрацией их спор в окружающей среде на протяжении
года.
Пыльцевые аллергены
Причиной развития пыльцевой бронхиальной астмы могут быть
аллергены трех основных групп растений. Это деревья и кустарники
(береза, ольха, лещина, или орешник, ива, дуб, каштан, тополь,
ясень, вяз и т.д.), злаковые травы (тимофеевка, райграс, овсяница,
лисохвост, мятлик, костер, пырей, рожь, греча, пшеница и т.д.),
сорные травы (лебеда, амброзия, одуванчик, конопля, крапива, полынь,
лютик и т.д.). В условиях климата средней полосы России отмечается
три пика обострений болезни: весенний (апрель-май), обусловленный
пыльцой деревьев; летний (июнь-август), связанный с пыльцой злаковых
растений; осенний (август-октябрь), обусловленный пыльцой сорных
трав. В зависимости от климатической зоны могут меняться сроки
цветения и спектр аллергенов (рис. 3-1).
Пыльцевая бронхиальная астма у детей нередко сочетается
с другими проявлениями поллиноза (аллергическим конъюнктивитом
и ринитом).
Лекарственные средства
У ряда детей с бронхиальной астмой различные лекарственные препараты могут индуцировать приступы удушья. Среди них ведущее место занимают антибиотики, особенно пенициллинового ряда, сульфаниламиды, витамины, аспирин и другие нестероидные противовоспалительные препараты. При этом контакт с лекарственными веществами возможен не только в ходе терапевтических мероприятий, но и вследствие загрязнения окружающей среды вблизи фармацевтических производств.
Вирусы и вакцины
Известны антигенные свойства вирусов. Однако, специфическая
роль вирусов в развитии бронхиальной астмы изучена не достаточно.
Вакцинация (особенно АКДС) может явиться пусковым фактором
манифестации бронхиальной астмы у отдельных детей. Вакцинация
больных с бронхиальной астмой требует известных предосторожностей,
при соблюдении которых она становится безопасной.
Химические вещества (ксенобиотики)
Ряд промышленных химических веществ (с достаточно высокой
молекулярной массой) обладают аллергенными свойствами, либо (в
случае гаптенов) приобретают такие свойства после адсорбции на
белках организма. Доказан вклад сенсибилизации к промышленным
химическим веществам (хрому, никелю, марганцу, формальдегиду)
в формирование бронхиальной астмы у детей. Под действием техногенного
загрязнения атмосферного воздуха может изменяться структура и
повышаться иммуногенность пыльцы и других “натуральных” аллергенов.
3.3. ФАКТОРЫ, СПОСОБСТВУЮЩИЕ
ВОЗНИКНОВЕНИЮ БРОНХИАЛЬНОЙ АСТМЫ
(повышающие риск развития бронхиальной астмы при воздействии причинных
факторов)
Респираторные инфекции
Острые вирусные респираторные инфекции у детей являются одним
из важнейших факторов, способствующих возникновению бронхиальной
астмы. Респираторные вирусы повреждают мерцательный эпителий слизистой
оболочки дыхательного тракта, увеличивают ее проницаемость для
аллергенов, токсических веществ и чувствительность ирритантных
рецепторов подслизистого слоя бронхов. Тем самым они повышают
бронхиальную гиперреактивность.
Многими исследователями отмечается повышенная частота развития
бронхиальной астмы у часто болеющих детей, перенесших круп, бронхиолит
или бронхит, коклюш.
Патологическое течение беременности у матери ребенка
Поскольку для плода внешней средой является организм матери, то все вредные воздействия на беременную женщину (работа в профессионально вредных условиях, контакт с аллергенами и ксенобиотиками, нерациональное питание, инфекционные заболевания) могут влиять и на будущего ребенка, обусловливая уже внутриутробную его сенсибилизацию и повышая риск развития, в частности, бронхиальной астмы.
Недоношенность
Имеются сообщения о склонности недоношенных детей к развитию
аллергии.
Возникновение бронхиальной астмы у недоношенных детей, возможно,
связано с уменьшенным калибром бронхов, а также с повышенной восприимчивостью
к вирусной и бактериальной инфекции, с нарушением пищеварения.
Однако роль фактора недоношенности не ясна и требует дальнейшего
изучения.
У детей раннего возраста пищевая аллергия играет важную роль
в формировании интерстициальных и кожных проявлений аллергии.
По некоторым данным, симптомы бытовой бронхиальной астмы у таких
детей появляются на 2,5-3 года раньше, чем в контрольной группе
детей, не имеющих клинико-анамнестических признаков пищевой аллергии.
Доказана протективная роль грудного вскармливания для развития
пищевой аллергии и уменьшения вероятности раУ звития бронхиальной
астмы, раннего начала и формирования в последующем тяжелого течения
болезни.
Атопический дерматит
Атопический дерматит наблюдается у 50-60% детей с атопией. В этой группе повышается риск развития бронхиальной астмы в 2-3 раза. В последние годы накопились данные о том, что у 30% детей с атопическим дерматитом развивается бронхиальная астма. Для такого рода ассоциаций (так называемый дермато-респираторный синдром) характерно упорное течение заболевания.
ОКРУЖАЮЩАЯ СРЕДА И БРОНХИАЛЬНАЯ АСТМА
- Индустриальный смог (двуокись серы в комплексе с твердыми частицами аллергенов).
- Фотохимический смог (двуокись азота; озон).
- Промышленные химические аллергены (формальдегид, ароматические углеводороды, хром, никель и др.).
- Аллергены БВК (белково-витаминного концентрата).
- Химические вещества, используемые в сельскохозяйственном производстве (пестициды, гербициды).
Поллютанты
Загрязнение атмосферного воздуха. Бронхиальная астма
у детей — экологически зависимое заболевание, так как фенотипическая
реализация наследственной предрасположенности к ней всегда осуществляется
при воздействии факторов окружающей среды. Именно поэтому бронхиальная
астма у детей является чувствительным маркером загрязнения атмосферного
воздуха.
Среди наиболее широко распространенных загрязнителей — окись
углерода, диоксиды серы и азота, металлы, пыль, продукты неполного
сгорания бензина (нефтеуглеводороды, формальдегид и др.). Особенно
агрессивен для дыхательных путей индустриальный и фотохимический
смог.
Промышленные химические загрязнители, особенно диоксид серы
и озон, оказывают непосредственное повреждающее действие на клетки
слизистой оболочки респираторного тракта, приводят к развитию
в ней воспаления, повышению проницаемости для аэроаллергенов,
тем самым снижая порог чувствительности к ним и повышая способность
к сенсибилизации. Отмечено промоторное действие сульфитов и нитритов
в отношении иммунокомпетентных клеток in vitro. В экологически
неблагополучных районах бронхиальная астма у детей чаще развивается
в более раннем возрасте, приобретает более тяжелое течение с преобладанием
клинических форм с поливалентной сенсибилизацией и большой частотой
интеркуррентных острых респираторных заболеваний.
Поллютанты помещений. Неблагоприятное влияние на детей
группы риска оказывает загрязнение воздушной среды жилых помещений
химическими соединениями. Новые строительные технологии, использование
современных отделочных материалов, систем вентиляции, подогрева
и увлажнения воздуха заметно изменили качество воздуха внутри
жилых помещений. Тем не менее, по материалам зарубежных авторов,
содержание аэрополлютантов в квартирах выше, чем в атмосферном
воздухе, в 3-4 раза.
Скопление большого количества ковров, матрасов и драпированной
мягкой мебели в квартирах с плохой вентиляцией заметно повышает
количество аллергенов клещей домашней пыли.
Существует много внутренних источников химического загрязнения
воздушной среды жилища :
- вещества, являющиеся продуктами жизнедеятельности человека
(аммиак, окислы азота и углерода, сероводород и др.);
- химические вещества (окись и двуокись углерода, двуокись
серы, оксид натрия и оксиды азота) и ингалируемые твердые частицы,
выделяющихся при использовании в быту для приготовления пищи и/или
в отопительных целях газовых плит, печей, каминов и т.д.;
- химические вещества, выделяющиеся строительными и отделочными
материалами.
Табакокурение
В настоящее время курение рассматривается как один из основных
факторов, влияющих на возникновение и течение бронхиальной астмы.
Табачный дым содержит около 4500 веществ, среди которых более
30 (полициклические углеводороды, окись углерода, окись азота,
аммиак, акролеин) оказывают прямое токсическое и раздражающее
действие на слизистую оболочку респираторного тракта, увеличивают
риск развития и утяжеление течения бронхиальной астмы.
Табачный дым понижает эффективность неспецифических и специфических
защитных систем. В первую очередь страдает мукоцилиарный клиренс
слизистых оболочек бронхов. Избыточная секреция, застой слизи,
снижение бактерицидных свойств и активности лизоцима являются
благоприятной средой для развития инфекции.
При систематическом воздействии аммиака на слизистые оболочки
дыхательных путей у детей могут возникать повторные бронхиты с
частым и продолжительным кашлем, одышкой, приступы бронхиальной
астмы.
В результате нарушения дренажной функции бронхов вредные вещества
табачного дыма скапливаются в нижних отделах бронхиального дерева
и продолжают оказывать пагубное действие, приводя к рефлекторному
бронхоспазму и усиливая бронхообструктивный синдром.
Пассивное курение. Респираторный тракт детей подвергается
интенсивному воздействию табачного дыма от курения окружающих.
Пассивные курильщики поглощают из прокуренной атмосферы помещения
столько же никотина и других токсических компонентов табачного
дыма, сколько и курящий.
У детей курящих родителей чаще развивается бронхиальная астма,
они раньше начинают болеть респираторными вирусными заболеваниями.
При этом тяжелые формы бронхиальной астмы у пассивных курильщиков
встречаются чаще, приступы удушья более продолжительны, труднее
поддаются лечению.
Пассивное курение у детей вызывает повышение бронхиальной гиперреактивности.
У детей с бронхиальной астмой, родившихся от активно и пассивно
курящих матерей, имело место более раннее развитие заболевания
( в возрасте до 2 лет). Сравнительный анализ результатов аллергологического обследования у детей,
страдающих бронхиальной астмой, показал, что у пассивных курильщиков
значительно чаще встречается пищевая (85,7% против 35,7%), пыльцевая
(45,3% против 26,1%), эпидермальная (26,2% против 21,4%)
сенсибилизация.
3.4. ФАКТОРЫ, ВЫЗЫВАЮЩИЕ ОБОСТРЕНИЕ БРОНХИАЛЬНОЙ АСТМЫ (триггеры)
Триггеры — факторы, вызывающие обострение бронхиальной астмы
путем стимуляции воспаления в бронхах или провоцирования острого
бронхоспазма или того и другого вместе. Среди триггеров выделяют
специфические (аллергены) и неспецифические (неаллергенные) воздействия.
Самыми частыми триггерами у детей являются контакт с
аллергенами и респираторно-вирусная инфекция.
Физическая нагрузка является характерным неспецифическим
стимулом, вызывающим приступы удушья у детей, больных бронхиальной
астмой. В основе развития бронхоспазма на физическую нагрузку
лежит повышение гиперреактивности бронхов, изменение температуры,
влажности и осмолярности секрета дыхательных путей при сопутствующей
гипервентиляции. В детском возрасте бронхоспазм на нагрузку не
встречается как изолированный феномен.
Психоэмоциональная нагрузка. Эмоциональный стресс, нервные
перегрузки, смех, плач, страх могут быть причиной бронхиальной
обструкции, провоцировать приступы удушья у детей, больных бронхиальной
астмой.
Изменение метеоситуации. Неблагоприятные погодные условия,
особенно низкие температуры, высокая влажность, падение или повышение
атмосферного давления, гроза, загрязнение воздуха, могут вызывать
обострение бронхиальной астмы у детей.
Загрязнение воздуха. Многие промышленные загрязняющие
вещества обладают ирритантным действием и, вызывая гиперреактивность
бронхов, могут увеличивать частоту приступов бронхиальной астмы.
Аналогичным действием обладают табачный дым, другие резкопахнущие
вещества (продукция парфюмерии, бытовой химии, дезинфектанты и
т.д.).
Среди других факторов, усугубляющих течение бронхиальной астмы,
следует выделить такие, как паразитарные инфекции и вирусный гепатит.
В последние годы появились сообщения о том, что паразитарные инфекции
(токсокароз и др.), а также носительство HbS антигена и других
маркеров вирусного гепатита у детей утяжеляют течение бронхиальной
астмы, затрудняют лечение и ухудшают прогноз заболевания. Также
появились данные о возможной роли таких болезнетворных агентов,
как микоплазма, легионелла, хламидии.
Психологические факторы. Особенности взаимоотношений
“мать—больной ребенок” жестко коррелируют с частотой рецидивирования
бронхиальной астмы. Остро стоит проблема организации психологической
помощи детям. Большое место в организации такой помощи уделяется
семье, так как она является опорой ребенку для преодоления кризисных
психологических ситуаций.
Причиной более тяжелого течения бронхиальной астмы могут быть
сопутствующие бактериальные инфекции верхних и нижних дыхательных
путей, перинатальные повреждения нервной системы, гастроэзофагальный
рефлюкс и другие состояния.
Выявление любого из вышеперечисленных факторов риска оказывает
неоценимую помощь в проведении активных профилактических мероприятий,
помогает значительно снизить частоту обострений бронхиальной астмы
у больных детей.
ГЛАВА IV
МЕХАНИЗМЫ РАЗВИТИЯ БРОНХИАЛЬНОЙ АСТМЫ У ДЕТЕЙ
4.1. ВОСПАЛЕНИЕ ДЫХАТЕЛЬНЫХ ПУТЕЙ ПРИ БРОНХИАЛЬНОЙ АСТМЕ У ДЕТЕЙ
Развитие бронхиальной астмы связано с гиперреактивностью крупных
и мелких дыхательных путей, являющейся проявлением хронического
воспаления. Воспаление координируется клетками, относящимися к
CD4+ лимфоцитам (Т - хелперам), так называемыми Th2 лимфоцитами.
Рис. 4-1 Схема
клеточных взаимодействий
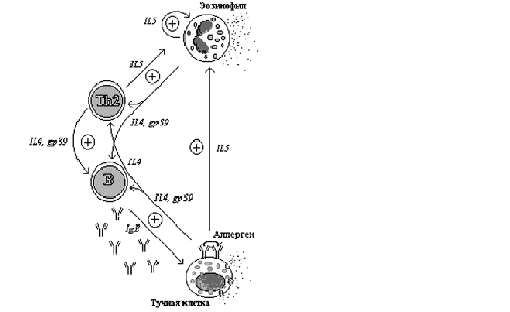
Т-хелперы 2 типа (Th2), тучные клетки
и эозинофилы с помощью схожего профиля цитокинов (IL-4, IL-5,
IL-13) и мембраносвязанных молекул (gp39) и секретируемых
b-лимфоцитов
IgE антител создают сеть взаимонаправленных позитивных сигналов,
поддерживающих аллергическое воспаление.
Обнаружение хронического воспаления, принципиально сместило
акценты терапии этого заболевания. Ключевым в лечении астмы стали
базисные препараты, подавляющие воспаление и тем самым снижающие
гиперреактивность бронхов и, кроме редких случаев резистентности,
устраняющие симптомы заболевания.
Начальные события, приводящие к доминированию Th2 лимфоцитов,
до конца не ясны, хотя существует много претендентов на роль пускового
звена Th2 опосредованной иммунной реакции, начиная с особенностей
антигена (аллергена) и заканчивая спонтанным эндогенным развитием
CD4+ лимфоцита в направлении Th2.
Этот путь дифференцировки характеризуется положительной обратной
связью, а другие клетки, вовлеченные в аллергическое воспаление
(тучные клетки, эозинофилы), продуцируют биологически активные
вещества, поддерживающие образование Th2. Лимфоциты характеризуются
особым профилем секретируемых цитокинов, в частности IL-4 и IL-5,
которые играют ключевую роль в формировании аллергического воспаления
(рис. 4-1). IL-4 и IL-13 (также продукт Th2 лимфоцитов) являются основными цитокинами,
обеспечивающими переключение В лимфоцита на синтез IgE антител.
IgE антитела, связываясь с FceRI тучных клеток, приводят, при
распознавании ими аллергии, к высвобождению медиаторовв, вызывающих
острые аллергические проявления и подготавливающих развитие позднефазовой
реакции, характеризующейся привлечением воспалительных клеток.
IL-5 является интерлейкином, избирательно активирующим эозинофилы,
являющиеся второй основной эффекторной клеткой аллергического
воспаления. И тучная клетка и эозинофил в процессе активации секретизирует
набор цитокинов подобный Th2 лимфоцитам, поддерживая тем самым
образование Th2 клеток, синтез IgE, сенсибилизацию тучных клеток
и участие эозинофилов.
В публикациях последнего года было показано, что лимфоциты
могут регулировать реактивность бронхов, в том числе вызывать
бронхиальную гиперреактивность, и вне антигенной стимуляции, не
используя в качестве посредников продукцию IgE или эозинофильную
инфильтрацию.
4.2. БИОЛОГИЧЕСКИЕ МАРКЕРЫ БРОНХИАЛЬНОЙ АСТМЫ
По определению Национальной медицинской библиотеки США (1996),
“Биологические маркеры — это количественно определяемые биологические
параметры, которые как индикаторы определяют здоровье, риск заболевания,
эффекты окружающей среды, диагностику заболевания, метаболические
процессы, эпидемиологию и т.д.” Применительно к бронхиальной астме
таким показателем являются морфологические и функциональные изменения
эозинофила. Большое значение в качестве биомаркера в последнее
время придается уровню оксида азота (NO) в выдыхаемом воздухе.
Характер воспалительных изменений, биомаркеры этого процесса
в совокупности с патофизиологическими изменениями и клинической
картиной позволяют отнести бронхиальную астму к самостоятельной
нозологической форме патологии человека.
4.3. НЕЙРОГЕННАЯ РЕГУЛЯЦИЯ ДЫХАТЕЛЬНЫХ ПУТЕЙ
Причиной изменения бронхиального тонуса считается нарушение
равновесия между возбуждающими (холинергическая, нехолинергическая
и a-адренергическая система) и ингибирующими (b-адренергическая и неадренергическая ингибирующие системы).
Нейрогенное воспаление с участием нейропептидов может сопровождать
и усугублять уже имеющееся аллергическое воспаление, инициатором
которого является реагин-зависимая реакция. При длительно сохраняющемся
воспалительном процессе происходит пролиферация нервных волокон,
несущих субстанцию Р с увеличением высвобождения нейропептида.
Вазоинтестинальный пептид (VIP) является важным регулятором
бронхиального тонуса, наиболее мощным эндогенным бронходилататором
из известных в настоящее время и способен противодействовать бронхоспазму
при астме. Вероятно, что дисфункция в VIP системе может возникнуть
вторично в процессе воспаления дыхательных путей при астме.
4.4. ЭНДОКРИННАЯ РЕГУЛЯЦИЯ
Регулирующее влияние эндокринной системы при бронхиальной
астме осуществляется через реализацию антистрессового эффекта,
адекватной защитной реакции организма против антигена. Оба эффекта
осуществляются через системы:
гипоталамус - гипофиз - надпочечники (кортиколиберин - АКТГ
- кортикостероиды - лимфоцит) - (ГГНС);
гипоталамус - гипофиз - тимус (соматолиберин - СТГ - тимус
- лимфоцит) - (ГГСТ);
гипоталамус - гипофиз - щитовидная железа (тиролиберин - ТТГ
- тиреоидные гормоны).
Особенностью детской бронхиальной астмы является наличие диссоциативных
нарушений внутри нейро-иммуно-эндокринного комплекса.
ГЛАВА V
ДИАГНОСТИКА И КЛАССИФИКАЦИЯ
|
КЛЮЧЕВЫЕ ПОЛОЖЕНИЯ:
|
5.1. КЛИНИЧЕСКАЯ ДИАГНОСТИКА
Анамнез и оценка симптомов
Клиническая диагностика бронхиальной астмы у детей базируется
на выявлении таких симптомов, характерных для данного заболевания,
как эпизодическая экспираторная одышка, свистящие хрипы, чувство
сдавления в груди, кашель.
Одышка носит, как правило, экспираторный характер с участием
вспомогательной мускулатуры. В силу анатомо-физиологических особенностей у детей раннего возраста
одышка чаще бывает смешанного характера и нередко сопровождается
повышением температуры тела, в связи с чем нередко таким больным
необоснованно ставится диагноз “ОРЗ” и назначаются антибиотики.
Кашель имеет приступообразный характер, иногда с отхождением густой,
вязкой мокроты.
Положение ребенка в момент астматического приступа вынужденное
— ортопноэ (нежелание лежать). Отмечается раздувание крыльев носа,
набухание шейных вен. Кожные покровы — бледные; цианоз носогубного
треугольника, акроцианоз. При физикальном обследовании в легких
на фоне неравномерно проводимого дыхания выслушиваются диффузные
сухие, свистящие хрипы, а также разнокалиберные влажные хрипы.
Последние особенно характерны для астматических приступов у детей
раннего возраста (так называемая “влажная астма”).
Симптомы болезни, как правило, появляются или усиливаются ночью
и в утренние часы.
В связи с тем, что клиническая симптоматика бронхиальной астмы
меняется в течение суток, обследование больного ребенка желательно
проводить при возникновении симптомов болезни и до приема бронхорасширяющих
средств.
Важное значение в диагностике заболевания принадлежит анамнестическим
сведениям. Большое значение имеют данные о наследственной отягощенности
аллергическими заболеваниями. Не менее важным является также выявление
у больного ребенка сопутствующих заболеваний аллергического генеза
(атопический дерматит, крапивница, отеки Квинке и др.). Бронхиальная
астма у детей нередко характеризуется упорно рецидивирующим течением.
Важное значение в диагностике бронхиальной астмы отводится указаниям
на зависимость возникновения симптомов заболевания от воздействия
тех или иных аллергенов и триггеров и улучшение состояния после
применения бронходилататоров.
Диагностика бронхиальной астмы у детей, особенно в раннем возрасте,
порой представляет значительные трудности, так как периодические
эпизоды бронхиальной обструкции могут быть проявлением разнообразной
патологии органов дыхания.
Начальные проявления бронхиальной астмы у детей раннего возраста
нередко носят характер бронхообструктивного синдрома, сопровождающего
респираторные вирусные инфекции. Скрываясь под маской острой респираторной
вирусной инфекции с обструктивным бронхитом, бронхиальная астма
иногда на протяжении длительного времени не распознается и больные
не лечатся. Вместе с тем, как показали отдаленные наблюдения (спустя
несколько лет после госпитализации по поводу обструктивного синдрома
при ОРВИ), более половины из числа этих детей страдают типичной
бронхиальной астмой. Таким образом, ОРВИ выступает в роли разрешающего
фактора при атопической бронхиальной астме у детей раннего возраста.
При повторении более трех эпизодов бронхообструкции в период ОРВИ
у ребенка первых лет жизни следует задуматься о возможности диагноза
бронхиальной астмы.
Необходимо заметить, что чем младше ребенок (имеется в виду
в возрасте до одного года), тем выше вероятность того, что повторяющиеся
эпизоды обструктивного синдрома астмой не являются.
В отличие от обструктивного бронхита, как проявления респираторной
инфекции, для детей раннего возраста с бронхиальной астмой характерны
выраженная наследственная отягощенность аллергическими заболеваниями
(особенно по материнской линии), большая частота аллергических реакций на пищевые продукты, медикаменты, профилактические
прививки; выраженные кожные аллергические проявления; бурное течение
обструктивного синдрома с ранним началом в период ОРВИ и меньшей
продолжительностью; отчетливый эффект бронхолитической
терапии; выраженные иммунологические изменения. Однако высокая
вариабельность как клинических признаков, так и лабораторных показателей,
затрудняет их использование в дифференциально-диагностических
целях. Практически ни один из этих показателей в отдельности (в
том числе уровень IgE) не может служить достаточно достоверным
дифференциально-диагностическим критерием обструктивного бронхита
и бронхиальной астмы в этом возрасте. Однако, для целей дифференциального
диагноза, может быть с успехом использован комплекс этих признаков
в целом.
Бронхиальная обструкция у детей может быть проявлением ряда
других заболеваний, таких как муковисцидоз, желудочно-пищеводный
рефлюкс, инородное тело трахеи и бронхов, пороки развития, нарушение
функции цилиарного эпителия, сдавление средостения увеличенным
тимусом, лимфоузлами или опухолью. Об этих состояниях следует
помнить при дифференциальной диагностике упорного и резистентного
к терапии бронхообструктивного синдрома.
Оценка функции внешнего дыхания
Степень обструкции наиболее резко выражена во время периодичеcки
повторяющихся приступов, однако, хотя и в меньшей мере, обструкция
сохраняется и после исчезновения клинических проявлений приступа,
а у многих больных и в межприступном периоде болезни, в особенности
при тяжелом течении астмы.
Важным отличием астмы от других хронических болезней легких
является обратимость обструкции. Она не имеет неуклонно прогрессирующего
течения, а характеризуется изменчивостью у одного и того же больного
в разные периоды болезни и даже в течение одного дня. При тяжелом
течении астмы в межприступном периоде часто имеется обструкция
воздухоносных путей. У больного после длительного межприступного
периода с хорошо сохраненной функцией легких может внезапно развиться
тяжелейший приступ с выраженной тотальной обструкцией и острой
дыхательной недостаточностью.
Спирометрические показатели функции внешнего дыхания позволяют
оценить степень нарушения вентиляционной способности легких, а
также наличие обструкции бронхов. Для этой цели используются параметры:
FVC (форсированная жизненная емкость легких), FEV1 (объем форсированного
выдоха за первую секунду), отношение FEV1/FVC. Эти параметры могут
быть измерены двумя способами: спирометрическим и пневмотахометрическим.
В современных приборах, как правило, информация выдается не только
в абсолютных значениях показателей, но и в процентах к должным
величинам.
Оценка показателей проводится по степени их отклонения от должных
величин, учитывающих рост. Некоторые должные величины также учитывают
возраст и пол, однако большинство исследователей полагает, что
рост у детей является основным фактором, тогда как возраст и пол
сами по себе влияют на указанные параметры очень мало.
Показатель FEV1 в норме составляет не менее 80% от должной
величины. Умеренно сниженным считается уровень от 79 до 60 %,
значительно сниженным — менее 60%. Нижней границей нормы FEV1/FVC
у детей можно считать 78%. Показатель FVC у детей, больных бронхиальной
астмой, является менее чувствительным для оценки бронхиальной
обструкции.
После приступа восстановление функции легких отстает от клинического
улучшения. Когда у детей уже нет ощущения удушья и затрудненного
дыхания, бронхиальная проходимость, по данным функциональных исследований,
еще остается нарушенной практически у всех больных, а после исчезновения
свистящих хрипов в легких — по крайней мере у половины. Недооценка
функционального состояния легких и преждевременное прекращение
лечения может вновь привести к приступу.
Нормальные показатели функции внешнего дыхания в периоде ремиссии
бронхиальной астмы не означают отсутствия гиперреактивности бронхов,
а неполное восстановление бронхиальной проходимости в периоде
ремиссии почти всегда сопровождается бронхиальной гиперреактивностью.
У каждого ребенка с подозрением на наличие бронхоспазма на
любом из доступных приборов следует зарегистрировать кривую FVC
и рассчитать FEV1 и FEV1/FVC.
Исследование газов крови и кислотно-основного состояния особенно
необходимо в период приступа, так как оно определяет меры
интенсивной терапии.
Лечение в межприступном периоде также должно проходить под
контролем функциональных исследований. Выбору бронхолитического
препарата для курсовой терапии помогают пробы с бронходилататорами.
Улучшение функциональных показателей дыхания (более 15%) после
ингаляции b2-агонистов свидетельствует о наличии у больного
скрытого бронхоспазма, не проявляющегося клинически.
Гипервосприимчивость дыхательных путей (Hyperresponsiveness)
отражает степень их воспаления и является одной из характерных
черт бронхиальной астмы. Этот термин является обобщающим для гиперчувствительности
(Hypersensitivity) и гиперреактивности (Hyperreactivity), обозначающих
соответственно смещение влево и увеличение угла наклона кривой
“доза-ответ”, получаемой в ходе бронхоконстрикторного теста.
Полное исследование функции легких в межприступном периоде
включает пробы на выявление гиперреактивности /гиперчувствительности
бронхов.
Бронхоконстрикторные тесты с применением метахолина, гистамина,
физической нагрузки методически разработаны и стандартизированы.
Большинством исследователей используются две общепринятые методики
ингаляции бронхоконстрикторов: непрерывная и дозиметрическая,
причем, предпочтение отдается последней, как более точной. Смысл
бронхоконстрикторного теста, независимо от ингалируемого агента,
состоит в том, что проводимым до и между ступенчато возрастающими
дозами вещества измерением FEV1 должно быть зарегистрировано 20%
падения этого показателя (PD20).
Бронхиальная гипервосприимчивость, хотя и является важным эпидемиологическим
критерием, тем не менее не может считаться специфичной только
для астмы.
На сегодняшний день в педиатрической практике бронхоконстрикторный
тест не может считаться основным функциональным методом подтверждения
диагноза бронхиальной астмы. Тем не менее, не следует отрицать
его диагностического значения в некоторых сомнительных случаях
в подростковом возрасте.
Бронхоскопия при бронхиальной астме у детей
Бронхоскопия является методом диагностики ряда заболеваний,
протекающих с нарушением бронхиальной проходимости, с которыми
необходимо дифференцировать бронхиальную астму, особенно при нетипичных
ее клинических проявлениях. Среди них — врожденная патология бронхолегочной
системы (пороки и аномалии развития трахеи и бронхов), инородные
тела бронхиального дерева (нередкие в педиатрической практике),
дискинезии трахеи и бронхов, эндобронхиальные опухоли, экстрабронхиальная
патология, а также бронхолегочные процессы неясной этиологии.
Использование поднаркозной бронхоскопии как рутинного исследования,
с целью диагностики астмы как таковой, нецелесообразно.
Лечебная бронхоскопия у детей с бронхиальной астмой
может быть показана при крайне тяжелых приступах и астматических
состояниях, с нарушением дренажной функции бронхиального дерева,
при наличии ателектазов, при развитии асфиктического синдрома.
Однако, даже при тяжелом status asthmaticus, вопрос о проведении
бронхоскопии остается чрезвычайно сложным. Поэтому использование
столь ответственного вмешательства, как бронхологическое пособие
при бронхиальной астме у детей, представляет терапевтическую дилемму.
Клинические особенности бронхиальной астмы у детей при сенсибилизации к различным аллергенам
Атопическая бронхиальная астма у детей, обусловленная сенсибилизацией
к аллергенам Dermatophagoides pteronyssimus, Dermatophagoides
farinae, домашней пыли, характеризуется возникновением более частых
приступов затрудненного дыхания в домашней обстановке нередко
симптомами ринита, при выезде из дома, смене места жительства
приступы урежаются. К уменьшению частоты приступов удушья у таких
больных ведет соблюдение надлежащего содержания жилых помещений
(устранение старой мебели, ковров, регулярная влажная уборка,
удаление домашней пыли). При возвращении в бытовые условия, сходные
с первоначальными, возможно возникновение приступов с прежней
частотой. Для клещевой бронхиальной астмы характерно возникновение
приступов затрудненного дыхания в ночные часы — в период наибольшей
экспозиции аллергенов микроклещей домашней пыли, присутствующих
в постельных принадлежностях.
При бронхиальной астме, вызванной сенсибилизацией к грибам
рода Cladosporium, Alternaria, приступы затрудненного дыхания
обычно учащаются в период образования спор грибов, — с марта и
до первых заморозков. При сенсибилизации к грибам рода Penicillium,
Aspergillus, Mucor, весьма распространенных в сырых помещениях
и дающих обильное образование спор круглогодично, приступы бронхиальной
астмы у детей возникают на протяжении всего года. Обострение грибковой
бронхиальной астмы чаще всего наступает при проживании ребенка
в сырых помещениях, а также при употреблении в пищу таких продуктов,
как грибы, сыр, кислое молоко, дрожжевое тесто и т.д., а также
при назначении лекарственных средств — производных грибов (антибиотики
пенициллинового ряда). Для больных грибковой бронхиальной астмой
характерно особенно тяжелое течение болезни, при этом нередко
имеет место развитие астматического состояния.
Пыльцевая бронхиальная астма обычно возникает в разгар цветения
некоторых растений. Учащение приступов бронхиальной астмы у таких
детей наблюдается в сухие ветреные дни — в периоды максимальной
концентрации пыльцы в воздухе и, наоборот, урежение их отмечается
в сырую дождливую погоду, вызывающую уменьшение концентрации пыльцы
растений в воздушной среде. Пыльцевая бронхиальная астма чаще
развивается уже на фоне существующих проявлений сезонного аллергического
ринита и аллергического конъюнктивита. У больных пыльцевой бронхиальной
астмой обострения болезни могут возникать и на протяжении последующих,
после окончания сезона цветения растений, месяцев в связи с употреблением
пищевых продуктов, имеющих общие антигенные детерминанты с пыльцой
деревьев (яблоки, орехи, березовый сок) и трав (ржаной и пшеничный
хлеб, изделия из пшеничной муки, семена подсолнуха, подсолнечное
масло, халва).
У детей нередко сочетание бронхиальной астмы и атопического
дерматита. В случае дермореспираторного синдрома основу заболевания
может составлять поливалентная сенсибилизация с гиперчувствительностью
к аллергенам домашней пыли, Dermatophagoides pteronyssimus, Dermatophagoides
farinae, грибковым, пыльцевым, пищевым, лекарственным аллергенам.
Течение заболевания у таких детей наиболее упорное, сопровождается
эозинофилией, высокими уровнями общего и специфических IgE в сыворотке
крови, гастроинтестинальной аллергией.
Бронхиальная астма, как проявление изолированной сенсибилизации
к аллергенам домашних животных, встречается лишь у отдельных больных.
Чаще выявляется сочетанная сенсибилизация аллергенами домашней
пыли, Dermatophagoides pteronyssimus, Dermatophagoides farinae
и эпидермальными аллергенами. У отдельных больных с астмой, вызванной
сенсибилизацией к аллергенам животных, отмечается склонность к
развитию крапивницы, аллергического отека, аллергического ринита.
Оценка аллергологического статуса
Для идентификации аллергена или группы аллергенов при бронхиальной
астме у детей широко используют кожные тесты. Наиболее часто применяют
скарификационные и уколочные тесты. Они достаточно специфичны
и высоко чувствительны.
Показанием для проведения кожных тестов является необходимость
подтверждения данных анамнеза и клиники, указывающих на роль того
или иного аллергена или группы аллергенов в возникновении симптомов
бронхиальной астмы.
Ставятся кожные тесты только в период клинической ремиссии
бронхиальной астмы и после санации очагов хронической инфекции.
Не проводят кожные тесты в период обострения атопического дерматита
и аллергического ринита, а также при лечении гормональными и антигистаминными
препаратами, поскольку они искажают (снижают) кожную чувствительность.
Противопоказаниями для аллергологического обследования с помощью
кожного тестирования являются обострение бронхиальной астмы, острые
интеркурентные инфекционные заболевания, острые психические расстройства.
В случаях тяжелого течения бронхиальной астмы, постоянного
рецидивирования, при необходимости выявления причинно-значимых
аллергенов для проведения соответствующих элиминационных мероприятий,
показано применение современных лабораторных методов диагностики:
радиоиммунные, иммуноферментные и хемилюминисцентные методы определения
специфических IgE и IgG антител в крови. Следует иметь в виду,
что даже при положительных иммунологических тестах у детей с бронхиальной
астмой необходимо их сопоставление с данными анамнеза и результатами
других методов диагностики, т.к. они могут отражать состояние
латентной сенсибилизации, быть результатом перекрестной чувствительности
или артефактом вследствие неправильной постановки кожных тестов,
либо низкого качества аллергенов. Ингаляционные провокационные
тесты с аллергенами трудоемки и опасны, в связи с чем у детей
не применяются.
Психологические аспекты бронхиальной астмы у детей
Известно, что длительное хроническое заболевание обусловливает
задержку эмоционального развития, эмоциональную незрелость. Хроническая
физическая и психическая астения тормозит развитие активных форм
деятельности, способствует формированию таких черт личности, как
робость, боязливость, неуверенность в себе. Эти же свойства обусловливают
и создание для больного ребенка режима ограничений и запретов.
Условия гиперопеки формируют искусственную инфантилизацию. У большинства
больных с астмой отмечается стремление к здоровью, появляются
интересы и рассуждения, свойственные взрослым.
Среди личностных особенностей детей с бронхиальной астмой доминируют
неустойчивость, эмоциональная лабильность, истероидность, эгоцентризм,
снижение способности к ролевому взаимодействию. Страх удушья формирует
тревожность, чувство отверженности, подкрепляемые переживаниями
своего отличия от сверстников. У подростков, больных астмой, личностные
особенности включают сдерживаемую неадекватную агрессию, проблемы
в конструктивном разрешении межперсональных отношений, инфантильное
поведение, зависимость, требовательный характер, “прилипчивость”.
Для детей с астмой характерным является более высокий уровень
негативных эмоций, более бедное воображение, неспособность отличить
эмоциональные проблемы от переживаемых физических нарушений. Специфические
личностные нарушения у них не выявляются, больные с астмой не
отличаются от других детей в приобретении навыков, в учебе.
Около 25-30% обострений заболевания связаны с периодами эмоционального
напряжения. Эмоциональный стресс сам по себе может быть пусковым
фактором обострения астмы. Смех, плач, страх, психологическое
давление в семье могут привести к гипервентиляции и реакции бронхоспазма.
К такому же эффекту приводят приступы паники у детей с астмой.
Психопатологические изменения чаще наблюдаются у детей с тяжелой
астмой, существенно ограничивающей жизнедеятельность ребенка,
его социальное развитие. Отягощают течение заболевания неспособность
ребенка самостоятельно справляться с кризисными ситуациями, обслуживать себя, длительные депрессии как следствие семейных конфликтов, отсутствие
эмоциональной близости с родителями.
Для успешного лечения больного с астмой необходима оценка его
эмоциональной сферы, изучение поведения ребенка с родителями дома,
в школе, среди друзей, оценка реакций ребенка на непосредственное
окружение, стресс.
Изменения поведения, особенно у детей, требующих стационарного
лечения, являются важными характеристиками, которые должны учитываться
в реабилитационных программах. Важное место занимают образовательные
программы (“Астма-школы”). Эффективное лечение в ранней стадии
может предотвратить последующие эмоциональные отклонения. Обычно
психические изменения вследствие бронхиальной астмы не требуют
психотерапии и достижение стойкой ремиссии ведет к нормализации
психики ребенка.
Варианты нервно-психических расстройств при астме
| 1.Усугубление преморбидных личностных
свойств на фоне хронической психотравмирующей ситуации. 2.Депрессия в приступном периоде. 3.Астенизация или депрессия в периоде ремиссии (ожидание приступа, страх). 4.Социальная дезадаптация. |
Бронхиальная астма у детей и гипервентиляционный синдром
Важное место при бронхиальной астме у детей занимают гипервентиляционные
нарушения, которые включают неадекватную гипервентиляторную реакцию
на различные воздействия. В развитии бронхообструкции при гипервентиляции
важное место занимает снижение температуры и влажности секрета
в респираторном тракте, что способствует бронхиальной гиперреактивности.
Нередко больным ставят диагноз астеновегетативного синдрома, вегето-сосудистой
дистонии. У детей с преобладанием тонуса симпатической вегетативной
нервной системы отмечается большая склонность к гипервентиляторным
реакциям.
В этой группе детей наблюдаются некоторые особенности течения
астмы. Чаще отмечается затруднение вдоха во время приступов, субъективное
ощущение нехватки воздуха, вздохи, нарушения поведения (тревожность,
эмоциональная лабильность), головные боли, сердцебиение, боли
в животе во время приступа. Нередко приступы развиваются при эмоциональных
стрессах, физических нагрузках. Склонность к гипервентиляции подтверждается
тенденцией к гипокапнии. Поддерживают и усиливают эти проявления
сопутствующая патология желудочно-кишечного тракта, эндокринной
системы, отклонения со стороны центральной и вегетативной нервной
системы. Астма, возникающая у детей после физической нагрузки,
по крайней мере частично является следствием действия гипервентиляции
на дыхательные пути.
Улучшение достигается комплексной терапией, обязательно включающей,
наряду с бронхолитиками, дыхательные упражнения, направленные
на поддержание нормального стереотипа дыхания во внеприступном
периоде.
Ночная астма у детей
При бронхиальной астме у значительного числа больных состояние
ухудшается ночью, что является отражением суточных ритмов с ночным
максимумом (концентрация гистамина в сыворотке, чувствительность
бронхов к гистамину и ацетилхолину, повышение тонуса парасимпатической
нервной системы) или минимумом (концентрация кортизола и катехоламинов
в сыворотке крови, температура тела, показатели вентиляции легких).
Как у взрослых, так и у детей, инспираторная активность мышцы
диафрагмы значительно снижается во время фазы быстрого сна (REM-сна).
При этом увеличивается время выдоха и изменяется соотношение времени
выдоха и вдоха, что, возможно, имеет значение в увеличении ночной
гипоксемии у многих больных с обструктивными заболеваниями легких
и способствует развитию ночных приступов удушья. У детей с астмой
гипоксемия сохраняется в ночные часы. Причем, отмечаются периоды
многократного падения насыщения крови кислородом за ночь, наиболее
часто в предутренние часы, когда увеличивается доля быстрого сна.
У некоторых детей с астмой во время сна фиксируется шумное дыхание
(“храп”), занимающее до 35% времени сна, что коррелирует с увеличением
ЧСС. Наличие такого феномена, наряду с падением напряжения кислорода
в крови, может косвенно указывать на апноэ во сне.
У 80% больных эффективным является назначение вечером пролонгированных
препаратов теофиллина или b-адреномиметиков в одноразовой дозе, применение препаратов, нормализующих тонус
вегетативной нервной системы, тренировка абдоминального дыхания.
Гастроэзофагальный рефлюкс и бронхиальная астма у детей
Известно, что гастроэзофагальный рефлюкс (ГЭР) может быть
одним из механизмов формирования бронхиальной астмы у детей.
Частота данного синдрома при бронхиальной астме колеблется
от 7 до 65%. Существуют следующие методы диагностики ГЭР:
- внутрипищеводная pH-метрия,
- рентгеноконтрастное исследование пищевода и желудка,
- фиброгастроскопия,
- ниточковый тест,
- определение содержания липидов в альвеолярных макрофагах.
Диагностические тесты вызывают иногда рвотный рефлекс и, как
следствие, — появление большого количества ложноположительных
результатов.
Бронхиальная астма и физическая нагрузка
У многих детей, больных атопической бронхиальной астмой, приступы
провоцируются физической нагрузкой.
Посленагрузочный бронхоспазм характерен для подавляющего большинства
детей, больных бронхиальной астмой (60-70%). В то же время бронхиальная
астма физического напряжения как самостоятельная форма заболевания
у детей, как правило, не встречается.
Посленагрузочный бронхоспазм является проявлением неспецифической
гиперреактивности бронхиального дерева, которая коррелирует с
тяжестью бронхиальной астмы.
Разные виды физической нагрузки неодинаково стимулируют посленагрузочный
бронхоспазм. Наиболее часто он развивается при беге, особенно
в гору, после степ-теста, при езде на велосипеде, очень редко
— при плавании. Причем, длительность нагрузки более значима, чем
ее интенсивность.
Посленагрузочный бронхоспазм может быть клинически выраженным,
проявляясь в виде типичного приступа бронхиальной астмы или же
обнаруживаться только при исследовании функции внешнего дыхания
в отсутствии клинических проявлений затруднения дыхания. При посленагрузочном
бронхоспазме у детей, больных бронхиальной астмой, имеет место
снижение функциональных показателей бронхиальной проходимости.
Наиболее информативным показателем является FEV1. Посленагрузочный
бронхоспазм обычно проходит спонтанно в течение 15-20 мин. у большинства
детей.
Общепринятым стандартным тестом физической нагрузки является
6-8 мин. бега на тредмиле или 6-10 мин. велоэргометрии (с постоянной
нагрузкой из расчета 1,5 Вт на 1 кг массы тела). Уменьшение при
этом функциональных показателей, характеризующих бронхиальную
проходимость более чем на 15%, свидетельствует о развитии патологического
бронхоспазма. Физическая нагрузка у части больных с бронхиальной
астмой вызывает двухфазную реакцию — раннюю и позднюю. Ранняя
реакция возникает непосредственно (через 3-5 мин.) после физической
нагрузки, поздняя — через 3-6 часов.
Для предупреждения посленагрузочного бронхоспазма перед физической
нагрузкой следует проводить ингаляцию симпатомиметиков, за 5-10
минут кромогликата или недокромила натрия за 30 минут.
Аспириновая триада у детей
Иногда приступы удушья у детей возникают после приема аспирина.
Однако термин “аспириновая астма” условен, т.к. астматические
атаки возникают не только при приеме аспирина, но и других нестероидных
противовоспалительных препаратов, производных салициловой кислоты,
пиразолона (амидопирин, анальгин), индола (индометацин), парааминофенола
(фенацитин), ингибирующих активность циклооксигеназы и угнетающих
синтез простагландинов.
Аспириновая триада включает анафилактоидную чувствительность
к нестероидным противовоспалительным препаратам, приступы удушья,
наличие носовых полипов. Непереносимость аспирина наблюдается
у 12-28% детей с атопической бронхиальной астмой. Эти больные
нередко требуют назначения кортикостероидной терапии.
Диагностика аспириновой непереносимости у детей представляет
большие трудности. Между тем, ее распознавание необходимо, т.к.
прием больными нестероидных противовоспалительных препаратов или
лекарственных средств, их содержащих, чреват тяжелыми осложнениями,
развитием анафилактоидных проявлений.
Методы диагностики аспириновой непереносимости с помощью провокационных
проб с аспирином, основанные на регистрации показателей внешнего
дыхания после приема больными малых доз препарата, не могут быть
использованы у детей из-за их опасности.
Аспириновая непереносимость может выявляться методом, основанным
на способности лейкоцитов больных высвобождать лейкотриены (количество
которых определяют с помощью высокоэффективной жидкостной хроматографии)
под воздействием индометацина in vitro.
Детям с аспириновой непереносимостью противопоказаны лекарственные
препараты, обладающие антициклооксидазной активностью, а также медикаменты, в состав которых
входит желтый пиразолоновый краситель — тартразин. Из питания
необходимо исключать продукты, содержащие ацетилсалициловую кислоту,
если есть признаки их непереносимости.
| Больным с аспириновой триадой необходимо исключить применение следующих
лекарственных препаратов: |
Кортикостероидозависимая бронхиальная астма у детей
Кортикостероидные препараты играют основную роль в лечении
тяжелых форм бронхиальной астмы.
Длительность приема кортикостероидных средств не имеет определяющего
значения и гормонозависимой является форма бронхиальной астмы,
которую нельзя контролировать без применения кортикостероидов.
Широкое внедрение ингаляционных кортикостероидных средств резко
уменьшило число больных, которым необходимо назначение гормональных
препаратов внутрь. Для ингаляционных кортикостероидных препаратов
характерна высокая местная противовоспалительная и низкая системная
активность.
Необходимость постоянного приема ингалируемых кортикостероидов
для поддержания стабильного состояния позволяет характеризовать
подобное течение бронхиальной астмы как “астму, зависимую от ингаляционных
кортикостероидов”.
Доза и длительность использования кортикостероидных препаратов
являются своеобразным индексом тяжести заболевания. При кортикостероидозависимой
бронхиальной астме только длительная гормональная терапия позволяет
контролировать течение заболевания. В подавляющем большинстве
случаев у больных, у которых наступил летальный исход, одной из
основных его причин являлось неприменение кортикостероидных препаратов
при обострении заболевания или их недостаточная дозировка.
Длительный прием кортикостероидных препаратов внутрь может
приводить к развитию осложнений, из которых у детей наиболее часты
синдром Иценко-Кушинга, диспропорция физического и полового развития,
надпочечниковая недостаточность, остеопороз. Значительно уменьшить
нежелательные эффекты кортикостероидной терапии позволяет применение
интермиттирующих схем их приема и использование ингаляционных
форм.
5.2.КЛАССИФИКАЦИЯ БРОНХИАЛЬНОЙ АСТМЫ У ДЕТЕЙ
В России длительное время традиционно выделяли атопическую
(аллергическую) и инфекционно-аллергическую (неатопическую) формы
бронхиальной астмы, а также смешанный ее вариант. В связи с этиологией
выделяют сезонную астму (как проявление поллиноза), другие патогенетические варианты болезни. Большое распространение имела классификация,
основанная на классических принципах А.А.Колтыпина и отражавшая
тип, тяжесть и течение болезни.
Исследования последних десятилетий позволили изменить взгляды
на бронхиальную астму, охарактеризовать ее как самостоятельную
нозологическую форму — хроническое аллергическое заболевание с
наследственным предрасположением. В связи с этим с практической
точки зрения на первый план выдвигается классификация бронхиальной
астмы по степени тяжести, что очень важно, так как определяет
современную стратегию ее терапии.
Выделение астматического бронхита также признано нецелесообразным,
т.к. он является клиническим вариантом бронхиальной астмы, характерным
в основном для детей раннего возраста.
Все особенности течения, клинические варианты, осложнения могут
быть отражены в структуре диагноза при его расшифровке..
|
Легкая |
Среднетяжелая |
Тяжелая |
|
| Частота приступов | Не чаще 1 раза в месяц | 3-4 раза в месяц | Несколько раз в неделю или ежедневно |
| Клиническая характеристика приступов | Эпизодические, быстро исчезающие, легкие | Приступы средней тяжести протекают с отчетливыми нару шениями функции внешнего дыхания | Постоянное наличие симптомов: тяжелые приступы, астматические состояния |
| Ночные приступы | Отсутствуют или редки | 2-3 раза в неделю | Почти ежедневно |
| Переносимость физической нагрузки, активность и нарушение сна | Не изменена | Снижение переносимости физи ческих нагрузок | Значительно снижена переносимость физических нагрузок |
| Показатель FEV1 и PEF в период обострения | 80% от должного значения и более | 60-80% от должного значения | Менее 60% |
| Суточные колебания бронхопроходимости | Не более 20% | 20-30% | Более 30% |
| Характеристика периодов ремиссии | Симптомы отсутствуют, нормальная функция внешнего дыхания | Неполная клинико-функциональная ремиссия | Неполная клинико-функциональная ремиссия (дыхательная недостаточность разной степени выраженности) |
| Длительность периодов ремиссии | 3 и более месяцев | Менее 3 месяцев | 1-2 месяца |
| Физическое развитие | Не нарушено | Не нарушено | Возможно отставание и дисгармоничноть
физического
развития |
| Способ купирования приступов | Приступы ликвидируются спон танно или однократным приемом бронхолитиков (в ингаляциях, внутрь) | Приступы купируются бронхолитиками (в ингаляциях и парентерально), по показаниям назначают — кортикостероидные препараты парентерально | Приступы купируются введением парентерально бронхоспазмали тиков в сочетании с кортикостероидами в условиях стационара, нередко — в отделении интенсивной терапии |
| Базисная противовоспалительная терапия | Кромогликат натрия, недокромил натрия | Кромогликат натрия или недокромил натрия, у части боль ных — нгаляционные кортикостероиды | Ингаляционные и системные кортикостероиды |
Характеристика тяжести бронхиальной астмы у детей
Наиболее рациональным является выделение легкой, среднетяжелой
и тяжелой астмы Следует отметить, что сделать заключение о тяжести
астмы иногда бывает непросто, хотя для разработки плана лечения
оно необходимо. При решении вопроса о тяжести болезни следует
учитывать анамнез (частота, тяжесть и длительность приступов удушья
и их эквивалентов, эффективность лечебных препаратов и процедур),
а также данные физикального, инструментального и лабораторного
обследования (см. рис. 5-1, 5-2, 5-3).
Легкая астма характеризуется редкими приступами (реже 1 раза
в месяц), сравнительно быстро исчезающими спонтанно или в результате
лечения. В периоде ремиссии общее состояние не страдает, показатели
внешнего дыхания колеблются в пределах возрастной нормы.
Рис. 5-2 Клинические параметры, характеризующие тяжесть приступа бронхиальной астмы
| 1.Частота дыхания. 2.Участие вспомогательной мускулатуры в акте дыхания. 3.Интенсивность свистящего дыхания. 4.Вздутие грудной клетки. 5.Характер и проведение дыхания в легких (при аускультации). 6.Частота сердечных сокращений. 7.Вынужденное положение. 8. Изменение поведения. 9.Степень ограничения физической активности. 10.Объем терапии (препараты и способы их введения), используемый для купирования приступа. Градации: -легкий приступ, -приступ средней тяжести, -тяжелый приступ, -крайне тяжелый приступ (астматический статус). |
Бронхиальная астма легкой степени врачами плохо диагностируется.
В критериях, положенных в определение легкой степени тяжести,
подчеркивается не только появление приступов удушья, но и кратковременное
возникновение некоторых симптомов болезни, в первую очередь —
кашля.
Рис. 5-3 Критерии оценки тяжести приступа бронхиальной астмы у детей
| Признаки | Легкий | Среднетяжелый | Тяжелый | Угроза остановки дыхания (status asthmaticus) |
| Физическая активность | Сохранена | Ограничена | Вынужденное положение | Отсутствует |
| Разговорная речь | Сохранена | Ограничена; произносят отдельные фразы | Речь затруднена | Отсутствует |
| Сфера сознания | Иногда возбужде ние | Возбуждение | Возбуждение, испуг, “дыхательная паника” | Спутанность сознания, гипоксическая или гипоксически-гиперкапническая кома |
| Частота дыхания* | Дыхание учащенное | Выраженная экспираторная одышка | Резко выраженная экспираторная одышка | Тахипноэ или брадипноэ |
| Участие вспомога тельной мускулатуры, втяжение яремной ямки | Нерезко выражено | Выражено | Резко выражено | Парадоксальное тора коабдоминальное дыхание |
| Свистящее дыхание | Отмечается обычно в конце выдоха | Выражено | Резко выражено | “Немое легкое”, отсутствие дыхатель ных шумов |
| Частота пульса* | Увеличена | Увеличена | Резко увеличена | Брадикардия |
| FЕV1, PEF* в % от нормы или лучших значений больного | Более 80% | 60-80% | Менее 60% от нормы | |
| PaO2 | Нормальные значения | Более 60 мм рт. ст. | Менее 60 мм рт. ст | |
| РаСО2 | Менее 45 мм рт. ст. | Менее 45 мм рт. ст. | Более 45 мм рт. ст. | |
| *Частоту дыхания пульса, FEV1, PEF необходимо определять повторно в процессе терапии. | ||||
При среднетяжелой астме приступы удушья повторяются 3-4 раза
в месяц, протекают с отчетливыми нарушениями функции дыхания и
кровообращения: тахипноэ, тахикардия, приглушение тонов сердца,
отчетливо регистрируется колебание максимального артериального
давления во время дыхательного цикла – повышение во время выдоха
и снижение – при вдохе. FЕV1 – 60-80%.
Тяжелая астма характеризуется частыми (несколько раз в неделю
или ежедневными) приступами удушья, возникающими на фоне выраженного
вздутия легких, одышки и тахикардии. Больные принимают вынужденное
положение. Кожные покровы бледно-серого цвета, отмечается цианоз
губ, вокруг рта, ушных раковин, кистей рук. Кашель мало-продуктивный,
выдох шумный, продолжительный, появляются втяжения грудной клетки
во время вдоха, в акте дыхания принимают участие дополнительные
дыхательные мышцы (грудино-ключичные, грудные, прямые мышцы живота
и др.). Во время приступа удушья максимальное артериальное давление
определяется только во время выдоха, во время вдоха тоны Короткова
не прослушиваются, пульс во время вдоха или не определяется или
наполнение и напряжение его резко снижены.
При диссоциации отдельных показателей тяжести (например, редкие,
но тяжелые приступы) бронхиальную астму следует характеризовать
по более тяжелому признаку.
В клинической практике целесообразно выделять крайне тяжелый вариант бронхиальной астмы. Все критерии тяжести максимально выражены,
больные имеют низкую чувствительность к стероидной терапии. У
больных повторно возникают астматические состояния, они получают
комбинированную фармакотерапию. Больные нередко нуждаются в интенсивной
терапии и даже реанимации.
Возможные осложнения: легочное сердце (острое, подострое и
хроническое), эмфизема легких, пневмосклероз, ателектаз легких
(сегментарный, полисегментарный), интерстициальная, медиастинальная
и подкожная эмфизема, спонтанный пневмоторакс, неврологические
и эндокринные расстройства.
В течении заболевания выделяют период обострения и период ремиссии.
Обострение может протекать в виде острого приступа или затяжного
состояния бронхиальной обструкции. Приступ бронхиальной астмы
— острый эпизод экспираторного удушья, затрудненного и/или свистящего
дыхания и спастического кашля при резком снижении показателя пиковой
скорости выдоха (PEF), четко отмечаемый пациентом и его окружающими.
Период обострения бронхиальной астмы — затяжное течение приступного
периода, характеризуемого длительным затруднением дыхания, длящегося
дни, недели, месяцы, в течение которых имеется клинически выраженный
синдром бронхиальной обструкции. В период такого астматического
состояния могут повторяться острые приступы бронхиальной астмы
различной тяжести.
Период ремиссии — межприступный период. Ремиссия может быть
полной или неполной, что определяется характером клинико-функциональных
показателей.
* * *
ГЛАВА VI
ПРОФИЛАКТИКА
|
КЛЮЧЕВЫЕ ПОЛОЖЕНИЯ:
|
6.1.ПЕРВИЧНАЯ ПРОФИЛАКТИКА БРОНХИАЛЬНОЙ АСТМЫ У ДЕТЕЙ
Первичная профилактика бронхиальной астмы должна проводиться
детям группы высокого риска. К ним относятся дети с наследственным
предрасположением к аллергическим реакциям и заболеваниям и прежде
всего к аллергическим болезням органов дыхания, а также дети,
в анамнезе которых имеют место указания на наличие атопического
дерматита, повторные эпизоды крупа, бронхообструктивного синдрома
при ОРВИ. Мерами профилактики бронхиальной астмы являются:
- устранение профессиональных вредностей у матери во время
беременности;
- прекращение курения во время беременности;
- рациональное питание беременной, кормящей женщины с ограничением
продуктов, обладающих высокой аллергенной и гистаминлибераторной
активностью;
- предупреждение острых респираторных вирусных инфекций у матери
во время беременности и у ребенка;
- ограничение лекарственного лечения во время беременности
строгими показаниями;
- грудное вскармливание;
- уменьшение экспозиции ребенка к аэроаллергенам жилищ;
- прекращение пассивного курения;
- использование методов физического оздоровления, закаливания
детей;
- уменьшение контакта детей с химическими агентами в быту;
- благополучная экологическая обстановка.
При сомнительной эффективности и значительной финансовой и
организационной нагрузке в каждом конкретном случае необходимо
реалистически сопоставить потенциальный успех и реальные проблемы,
с которыми сталкнется семья при попытке выполнения перечисленного
комплекса первичной профилактики астмы.
6.2. ПРОФИЛАКТИКА ОБОСТРЕНИЯ БРОНХИАЛЬНОЙ АСТМЫ
Целями вторичной профилактики являются предупреждение:
- обострений астмы;
- утяжеления ее течения;
- осложнений;
- летального исхода.
Профилактика обострений бронхиальной астмы у детей строится
на основе устранения контакта с причинно-значимыми аллергенами
и неаллергенными триггерами, а при невозможности полной элиминации
— на максимальном снижении экспозиции их воздействия. Обмен информацией
при первичной и текущих консультациях расширяет представление
о триггерах, обогащает пациентов и врача полезными для дальнейшей
работы знаниями. При этом пациенты получают советы (в том числе
в письменной форме, в виде памяток, буклетов и т.д.) о мерах по
устранению причинно-значимых факторов и контролю за ними.
Из питания больных бронхиальной астмой должны быть исключены
пищевые продукты, являвшиеся доказанной причиной обострения болезни.
Подлежат полному исключению из применения лекарственные препараты,
использование которых вызывало приступы удушья или другие аллергические
проявления. Важное значение в профилактике обострений бронхиальной
астмы имеет снижение уровня экспозиции к аэроаллергенам жилищ.
При выявлении связи обострений болезни с сенсибилизацией можно
рекомендовать их удаление из жилых помещений. У больных с выявленной
сенсибилизацией к аллергенам пера птиц рекомендуется в качестве
набивного материала в подушках использовать синтепон или аналогичные
искусственные материалы. В квартирах больных бронхиальной астмой
детей не рекомендуется следует содержать аквариумы, поскольку
сухой корм для рыб (дафнии) обладает выраженной аллергенной активностью.
В связи с тем, что грибковая бронхиальная астма чаще всего вызывается
сенсибилизацией к плесневым грибам, весьма важным в системе мер
профилактики обострений этого клинического варианта астмы является
устранение избыточной влажности и очагов плесени в жилых помещениях.
В случаях бронхиальной астмы, обусловленной сенсибилизацией к
аллергенам домашней пыли, Dermatophagoides pteronyssimus, Dermatophagoides
farinae, эффективными мерами профилактики обострений астмы являются
ежедневная влажная уборка жилых помещений и регулярное удаление
домашней пыли механическим путем, с помощью пылесоса (в отсутствии
ребенка), устранение коллекторов пыли (ковров, паласов, старой
мягкой мебели, прикроватных ковриков), стирка постельного белья
при t > 60°C, регулярное проветривание постельных принадлежностей
на открытом воздухе в солнечную жаркую или морозную погоду. У
больных пыльцевой бронхиальной астмой уменьшение контакта с пыльцой
причинно-значимых растений можно достичь путем ограничения прогулок,
кондиционирования воздуха жилых помещений, а в случаях тяжелого
течения пыльцевой бронхиальной астмы - путем временного переезда
в климатические зоны, где период цветения причинно-значимых растений
завершился или еще не начался.
Частота обострений бронхиальной астмы у детей может быть также
снижена за счет предупреждения воздействия неспецифических триггерных
факторов: пассивного курения, избыточного контакта с химическими
соединениями, стрессорных ситуаций. В ряде случаев избежать обострения
бронхиальной астмы при воздействии аллергенных стимулов и неспецифических
факторов (физическая нагрузка, изменение метеоситуации, ухудшение
экологической обстановки в связи с химическими выбросами) позволяет
превентивное назначение ингаляционных b2-агонистов, кромогликата или недокромила натрия.
Вирусная респираторная инфекция должна рассматриваться как
фактор риска, который может иметь отношение к развитию бронхиальной
астмы в детском возрасте и провоцировать обострения заболевания.
Необходимо использовать комплекс мер по снижению заболеваемости
ОРВИ. У больных с тяжелой астмой при первых симптомах ОРВИ необходимо
начать применение бронхолитических препаратов продолжить кортикостероиды.
Меры профилактики не должны снижать качество жизни ребенка
и семьи в большей степени, чем собственное заболевание. Все мероприятия,
изменяющие образ жизни больного или семьи должны быть тщательно
взвешены врачом, а в случае их назначения объективно оценены их
положительные и отрицательные эффекты.
6.3.ВАКЦИНАЦИЯ ДЕТЕЙ С БРОНХИАЛЬНОЙ АСТМОЙ
1. Иммунизация проводится детям с бронхиальной астмой легкой
и средней тяжести, в редких случаях (по строгим эпидемиологическим
показаниям) — больным с тяжелой астмой (только в стационаре).
2. Иммунизации не подлежат дети в приступном периоде бронхиальной
астмы.
3. Вакцинация может быть проведена следующим категориям больных:
- детям с наличием легких и умеренно выраженных явлений бронхоспазма,
с нарушением вентиляционной функции легких (по данным спирографии
и пневмотахометрии). Они могут быть иммунизированы с использованием
АДС, АДС-М-препаратов, противополиомиелитной вакцины (по показаниям
вакцины против гепатита В) в стационаре или в кабинетах по иммунопрофилактике;
- детям с ремиссией болезни продолжительностью от 1 до 2 месяцев.
Они вакцинируются теми же препаратами в кабинетах по иммунопрофилактике.
При определенных ситуациях (эпидемиологической обстановке, семейные
обстоятельства и проч.) таких детей можно вакцинировать ЖКВ (живой
коревой вакциной), БЦЖ;
- детям с ремиссией заболевания продолжительностью 3 - 6 месяцев
и более. Они могут быть иммунизированы участковым педиатром АДС,
АДС-М - препаратами, ЖКВ, вакциной против полиомиелита.
Вакцинация всегда проводится на фоне базисного лечения основного
заболевания.
Дети, получавшие специфическую аллерговакцинацию (САВ), могут
быть вакцинированы по эпидемиологическим показаниям АДС-М, АДС-препаратами,
противополиомиелитной вакциной через 2-4 недели после введения
очередной дозы аллергена с последующим продолжением САВ через
4-5 недель после вакцинации. При этом САВ необходимо продолжить
с введения того разведения, которое было перед вакцинацией. Кожные
пробы с аллергенами могут быть поставлены за 10-15 дней до или
через 1,5-2 мес. после введения вакцинных препаратов.
При сочетании бронхиальной астмы с поллинозом вакцинацию детей
нельзя проводить в период поллинации причинно-значимых растений
- с апреля по октябрь.
6.4. ОБЕСПЕЧЕНИЕ РЕГУЛЯРНОГО НАБЛЮДЕНИЯ
Наиболее слабым звеном в длительном лечении больных бронхиальной
астмой является отсутствие должного контроля за течением заболевания,
эффективностью терапии. Вместе с тем, хронический характер данного
страдания, постоянная угроза обострения диктуют необходимость
подобного контроля.
Успешная реализация терапевтических программ по бронхиальной
астме возможна лишь при динамическом наблюдении за больными детьми,
позволяющем оценить адекватность и эффективность проводимого лечения,
своевременно вносить в него соответствующие коррективы.
Современная технология лечения бронхиальной астмы подразумевает
равную ответственность как пациента, его семьи, так и врача за
успех лечения, их партнерские взаимоотношения и обоюдную заинтересованность.
Именно союз лечащего врача, понимающего суть бронхиальной астмы
у конкретного больного, и больного (членов его семьи), знающего
особенности своего заболевания, образа жизни, способного контролировать
свое состояние и проводимую терапию, позволяет установить единство
действий, избежать осложнений, обеспечить постоянное наблюдение
за течением болезни.
Лечение бронхиальной астмы и наблюдение за ее течением у детей
проводится в амбулаторных условиях педиатром, а при необходимости
пульмонологом и аллергологом.
Условием для успешной терапии БА у детей является доступность:
1 - необходимых лекарственных препаратов;
2 - образовательных программ для больных детей и их родителей
(астма-школа).
3 - специалистов по бронхиальной астме и по смежным специальностям
(физиотерапевт, ЛОР, эндокринолог, психолог, специалист по лечебной
физкультуре);
4 - санаторно-курортного и других немедикаментозных методов
лечения;
5 - специфическая вакцинация аллергенами (специфическая иммунотерапия).
В функцию лечащего врача входит:
- инструкции по ведению острого приступа, обеспечения медикаментами
для скорой помощи (бронхолитики, кортикостероиды),
- составление индивидуального терапевтического плана; составление
письменных инструкций для больного (семьи);
- регулярные текущие консультации;
- контроль за состоянием больного;
- обучение больного и членов его семьи умению использовать
необходимые лекарственные препараты;
- разработка совместно с семьей мероприятий по организации
окружающей среды, контроль их выполнения;
- выбор немедикаментозных методов лечения;
- обеспечение связи со специалистами по бронхиальной астме;
- обеспечение связи со смежными специалистами;
- мониторирование течения заболевания;
- обучение навыкам самоконтроля и ведения дневника самонаблюдения.
- контроль выполнения назначений.
Ведение дневника самонаблюдения является обязательным элементом
лечебного комплекса. Совместное (врач-пациент-семья) обсуждение
внесенных в дневник данных позволяет врачу более глубоко вникнуть
в суть заболевания, а самому больному (родителям) совершенствовать
свои знания на примере “собственной” ситуации и в дальнейшем регулировать
(в пределах индивидуального комплекса) прием лекарственных препаратов
(симпатомиметиков, метилксантинов и др.), использовать другие
методы лечения.
Совет специалиста по астме должен быть получен при:
- отсутствии эффекта от проводимой терапии;
- недостаточном контроле за симптомами астмы;
- при тяжелом течении астмы;
- чрезвычайных обстоятельствах (переезд, операция, травма,
стресс);
- осложнениях астм.
Регулярность наблюдения зависит от тяжести и периода заболевания.
В период ремиссии при легкой бронхиальной астме осмотр врача осуществляется
не реже одного раза в 6 месяцев, при среднетяжелой — 1 раза в 3 месяца. Частота текущих консультаций при тяжелом течении
болезни определяется индивидуально.
Больным (и членам их семей) следует помочь в установлении пусковых
факторов.
ГЛАВА VII
ЛЕЧЕНИЕ БРОНХИАЛЬНОЙ АСТМЫ У ДЕТЕЙ
7.1. МОНИТОРИРОВАНИЕ ТЕЧЕНИЯ БРОНХИАЛЬНОЙ АСТМЫ У ДЕТЕЙ
КЛЮЧЕВЫЕ ПОЛОЖЕНИЯ:
- Астму можно эффективно контролировать у большинства больных, однако вылечить ее не удается.
- Плохая диагностика и неадекватная терапия - основные причины тяжелого течения и смертности от астмы.
- Выбор лечения должен быть сделан с учетом тяжести течения и периода бронхиальной астмы. Однако в любом случае необходим индивидуальный подход в выборе средств и методов лечения.
- При назначении лекарственных препаратов рекомендуется “ступенчатый” подход, который включает в себя увеличение количества и частоты приема лекарств по мере возрастания тяжести течения астмы.
- Наиболее эффективным лечением атопической астмы является элиминация причинно-значимого аллергена, однако на практике это возможно далеко не всегда.
- Наряду с медикаментозными на практике в комплексной терапии часто используются и немедикаментозные методы лечения. Эффективность большинства из них не доказана и нуждается в дальнейшем изучении.
- Успешное лечение бронхиальной астмы невозможно без установления партнерских, доверительных отношений между врачом, больным ребенком, его родителями и близкими.
Постоянное
наблюдение за детьми, больными
бронхиальной астмой, дает
возможность контролировать
течение заболевания, эффективность
проводимой терапии, вносить
соответствующие лечебные
коррективы.
Оценка течения бронхиальной
астмы у детей проводится при
посещении врача, на основании
анкетного опроса больных,
характера клинических проявлений и
исследования функционального
состояния внешнего дыхания.
Анкетный опрос осуществляется
по специально составленной форме,
заполняемой больным ребенком
(родителями), с оценкой состояния
ребенка, динамикой и качеством
симптомов заболевания, наличием
сопутствующих заболеваний, частоты
применения и эффективности
лекарственных препаратов. Больные
дети и их родители должны быть
хорошо информированы о течении
заболевания и признаках болезни,
уметь распознавать обострение
заболевания, оценивать
выраженность соответствующих
симптомов (кашель, одышка,
свистящие хрипы, характер сна и др.),
анализировать влияние факторов
окружающей среды на течение
заболевания.
Оценка тяжести течения
заболевания ведется врачом на
основании учета тяжести и частоты
обострений бронхиальной астмы,
состояния ребенка в межприступном
периоде, объема оптимальной
терапии, приносящей эффект.
До 5 лет оценка и мониторинг
тяжести астмы с анализом
показателей внешнего дыхания,
включая PEF, невозможны. Поэтому
определение тяжести астмы у
большинства детей должно
основываться на клинических
критериях, результатах
анкетирования, данных дневника.
Измерение PEF у детей школьного
возраста в поликлинике,
стационарах, домашних условиях
служит объективным параметром для
оценки степени бронхиальной
обструкции и составления лечебных
рекомендаций. Техника
пикфлоуметрии, правильность
интерпретации полученных данных и
адекватность реагирования на
изменение показателей должны
контролироваться врачом и
родителями. Результаты
пикфлоуметрии заносят в дневник
самонаблюдения (рис. 7-1).
Измерение газов артериальной
крови может обеспечить важный
контроль при оценке тяжести
обострения астмы. Измерение
сатурации кислорода (пульсовая
оксиметрия) должна проводиться в
отделениях интенсивной терапии:
при этом нижний уровень значения О2 не должен быть менее
95%.
- ПРЕДОТВРАЩЕНИЕ РАЗВИТИЯ УГРОЖАЮЩИХ ЖИЗНИ СОСТОЯНИЙ И ЛЕТАЛЬНЫХ ИСХОДОВ.
- ЛИКВИДАЦИЯ ИЛИ СМЯГЧЕНИЕ КЛИНИЧЕСКИХ ПРОЯВЛЕНИЙ ЗАБОЛЕВАНИЯ.
- УМЕНЬШЕНИЕ ЧАСТОТЫ И ВЫРАЖЕННОСТИ ОБОСТРЕНИЙ.
- НОРМАЛИЗАЦИЯ ИЛИ УЛУЧШЕНИЕ ПОКАЗАТЕЛЕЙ ФУНКЦИИ ВНЕШНЕГО ДЫХАНИЯ.
- ВОССТАНОВЛЕНИЕ И ПОДДЕРЖАНИЕ ЖИЗНЕННОЙ АКТИВНОСТИ (СООТВЕТСТВУЮЩЕЙ ВОЗРАСТУ), ВКЛЮЧАЯ ПЕРЕНОСИМОСТЬ ФИЗИЧЕСКИХ НАГРУЗОК.
- ОТМЕНА ИЛИ СНИЖЕНИЕ ПОТРЕБНОСТИ В БРОНХОЛИТИЧЕСКОЙ ТЕРАПИИ.
- ПРЕДОТВРАЩЕНИЕ ПОБОЧНЫХ ЭФФЕКТОВ ЛЕКАРСТВЕННОЙ ТЕРАПИИ.
- ПРЕДУПРЕЖДЕНИЕ ИНВАЛИДИЗАЦИИ.
Рис. 7-1 Вариант дневника пациента
| Дата | PEF | Заложенность носа | Кашель | Свистящее дыхание | Потребность в бронхолитиках | Базисная терапия |
| утро вечер | день ночь | день ночь | день ночь | |||
| Примечание: “-” -
отсутствие симптома.. “+” -
симптом выражен слабо. “++” -
симптом выражен значительно.
“+++” - максимальное проявление
симптома для данного больного. Если больной получал ингаляцию бронхолитического препарата, отметьте в дневнике PEF в течение первых 4-х часов после приема лекарственного средства. |
||||||
|
Возраст (лет) |
||||
|
Рост |
Мальчики |
Девочки |
||
|
(см) |
5-14 |
15 |
5-14 |
15 |
|
100 |
24 |
39 |
||
|
105 |
51 |
65 |
||
|
110 |
77 |
92 |
||
|
115 |
104 |
118 |
||
|
120 |
130 |
145 |
||
|
125 |
156 |
171 |
||
|
130 |
183 |
197 |
||
|
135 |
209 |
224 |
||
|
140 |
236 |
414 |
250 |
348 |
|
145 |
262 |
423 |
276 |
355 |
|
150 |
289 |
432 |
303 |
360 |
|
155 |
440 |
329 |
366 |
366 |
|
160 |
488 |
356 |
371 |
371 |
|
165 |
368 |
456 |
382 |
376 |
|
170 |
394 |
463 |
408 |
381 |
|
175 |
421 |
469 |
435 |
385 |
|
180 |
479 |
390 |
||
|
185 |
482 |
394 |
||
|
190 |
488 |
398 |
||
|
* (По Godfrey S.,Kamburoff Pl., Nairn J.R. Spirometry,lung volumes and
airway resistance in normal children aged 5 to 18 years.
Brit.J.Dis.Chest, 1970; 64:15).
|
||||
7.2.ФУНКЦИОНАЛЬНАЯ ОЦЕНКА И МОНИТОРИРОВАНИЕ ТЯЖЕСТИ БРОНХИАЛЬНОЙ АСТМЫ
Для оценки
тяжести течения бронхиальной
астмы, наряду с клиническими
симптомами, рекомендуется
опираться на результаты
спирографического измерения
объема форсированного выдоха за 1
сек (FEV1) и измерения пикового
экспираторного потока ( PEF) с
помощью пикфлоуметра.
При бронхиальной
астме легкого течения величины FEV1 и
PEF не изменяются, их значения выше 80%
от должного, а суточные колебания PEF
составляют менее 20 %. (Исследования
следует проводить до приема
лекарств.).
Умеренная по тяжести
бронхиальная астма сопровождается
снижением FEV1 и PEF в пределах 60-80% от
должного значения. Суточные
колебания показателя PEF составляют
20-30% и показатель PEF обычно
нормализуется после приема
бронходилататора.
Тяжелая бронхиальная астма
характеризуется значительным
снижением показателей FEV1 и PEF (менее
60% от должного значения),суточный
разброс значений PEF превышает 30% и
оптимальная терапия не возвращает
показатель к норме.
Для мониторинга бронхиальной
астмы в домашних условиях у детей
старше 5-6 лет рекомендуется
использовать пикфлоуметрию —
ежедневное измерение максимальной
скорости выдоха. Объективный
контроль за функцией легких очень
важен как для куратора, так и для
пациента, он позволяет оценить
течение болезни, контролировать
эффективность лечения и при
необходимости своевременно
проводить его коррекцию.
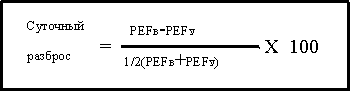
В педиатрии
мониторинг бронхиальной астмы с
помощью пикфлоуметрии еще не
получил широкого признания. Одной
из основных задач педиатра
является донесение до родителей
ребенка, страдающего бронхиальной
астмой, а в случаях с подростками —
до сознания самого ребенка
важности динамического
исследования функционального
состояния легких.
Нормальные значения
максимального потока выдоха
зависят от возраста пациента, его
физического развития и обычно
приложены в виде
таблицы к пикфлуометру. Приводимые
в литературе должные значения
пикового экспираторного потока
различаются. Приводим показатели PEF
по Godfrey et al.(1970) (рис. 7-2).
Целесообразно в период, когда
пациент чувствует себя хорошо, при
отсутствии клинических признаков
обструкции провести исследование
функции легких с помощью
спирометрии или исследования
кривой поток-объем форсированной
жизненной емкости легких.
Параллельно с этим исследованием
необходимо провести пикфлоуметрию
на приборе, которым будет
пользоваться пациент. Тест
выполняется в положении стоя.
Ребенку необходимо объяснить, что
он должен набрать в легкие как
можно больше воздуха , а затем
выдохнуть этот воздух максимально
быстро. Форсированный выдох
выполняется трижды и максимальное
значение выбирается в качестве
исходного, с которым сравниваются
все дальнейшие измерения как при
мониторировании функции дыхания в
домашних условиях, так и при
последующих визитах к врачу.
Увеличение числа попыток до 5
незначительно увеличивает
величину PEF.
Объективную информацию о
функции легких у детей можно
получить начиная с 5-летнего
возраста. Врач должен научить
технике правильного выполнения
дыхательного маневра PEF с тем, чтобы
в дальнейшем избежать ошибочной
оценки неправильно выполненного
теста. Наблюдения за
мониторированием PEF в домашних
условиях с помощью электронного
пикфлоуметра показали, что даже
взрослые пациенты, страдающие
бронхиальной астмой, часто не
соблюдают часы, кратность и
регулярность измерения PEF.
Как известно, измерения PEF проводят утром и
вечером, а в случаях приема
бронходилатирующих препаратов —
до и после их применения.
Своевременное измерение PEF важно по
той причине, что ежедневно должна
проводиться оценка изменчивости
показателя, которая позволяет
контролировать течение
бронхиальной астмы. Эта
изменчивость может быть рассчитана
по формуле:
Если пациент использует
бронходилатирующее средство, то
учитывается разница между утренним
значением до приема препарата и
вечерним измерением PEF после приема
лекарства.
Эффективность мониторирования
PEF в домашних условиях зависит от
нескольких факторов. Важно
соблюдать часы утреннего и
вечернего выполнения теста.
Полученные результаты обязательно
должны регистрироваться. Обычно к
пикфлоуметрам прилагаются схемы
или дневники регистрации
полученных данных. Если ребенок
дома получает лечение
(бронходилататоры) постоянно или
родители в силу обстоятельств
вынуждены прибегнуть к их
использованию, исследование PEF
должно быть выполнено до и после
приема лекарства, и это необходимо
отразить в дневнике. Важным
является знание родителями тех
обстоятельств, когда следует
обратиться за врачебной помощью до
оговоренной даты следующего
посещения (при суточном колебании
PEF свыше 20%).
Для того, чтобы помочь пациенту
контролировать течение
бронхиальной астмы, были
разработаны специальные зоны
(зеленая, желтая, красная).В
соответствии с этими зонами врач
устанавливает нижние границы
значения PEF, равные 80 и 60% от
должного значения PEF (или от лучшего
результата, полученого у ребенка
вне периода
обострения).
“Зеленая зона” — показатель
нормы — астма под контролем.
Физическая активность и сон не
нарушены, симптомы болезни
минимальны или отсутствуют. PEF > 80%
должных или лучших индивидуальных
показателей. Суточный разброс
показателей не превышает 20%.
Терапия определяется тяжестью
течения астмы. При сохранении
стабильного состояния в течение не
менее 3 мес. может ставиться вопрос
об отмене или уменьшении объема
терапии.
“Желтая зона” — сигнал
“Внимание”. Появляются
клинические симптомы астмы в виде
кашля, свистящих хрипов, одышки
(особенно ночью), тяжести в груди.
Снижается активность, нарушается
сон. PEF - 60-80% от должных или лучших
индивидуальных значений с суточным
разбросом 20-30%. Переход в “желтую
зону” указывает на начинающееся
или развившееся обострение.
Необходим прием препаратов в
соответствии с назначениями врача
при этой клинической ситуации, при
необходимости — усиление базисной
терапии.
“Красная зона” — сигнал
тревоги. Симптомы астмы
присутствуют в покое и при
нагрузке. Отмечаются кашель, одышка
с участием в дыхании
вспомогательной мускулатуры.
Значение PEF < 60% от должных или
лучших индивидуальных значений с
суточным разбросом более 30%.
Необходим прием препаратов для
экстренной помощи (согласно
рекомендованному врачом плану),
незамедлительное обращение за
медицинской помощью. Переход в
“красную зону” свидетельствует о
необходимости пересмотра плана
медикаментозной терапии в
“зеленой зоне”.
7.3. БАЗИСНАЯ ТЕРАПИЯ БРОНХИАЛЬНОЙ АСТМЫ У ДЕТЕЙ
КЛЮЧЕВЫЕ ПОЛОЖЕНИЯ- Рациональное использование лекарств с учетом путей их введения (предпочтителен ингаляционный способ введения).
- Ступенчатый (в зависимости от тяжести заболевания) подход к лечению (cм. схему базисной терапии).
- У детей старше 5 лет базисная терапия проводится обязательно под контролем функции внешнего дыхания: пикфлоуметрии, спирометрии (FEV1).
- Базисная терапия определяется с учетом исходной степени тяжести заболевания на момент осмотра больного; проводится длительно; отменяется при достижении стойкой ремиссии.
- Выбор методов лечения больного определяется врачом, учитывающим конкретную клиническую ситуацию.
Основу терапии бронхиальной астмы у детей составляет противовоспалительная терапия. В случаях обострения бронхиальной астмы осуществляется подключение бронхоспазмолитических средств. Характер проводимого противорецидивного лечения определяется тяжестью бронхиальной астмы, возрастом больных детей, динамикой состояния больного на фоне начатой превентивной терапии.
Детям с легкой и среднетяжелой бронхиальной астмой противовоспалительная терапия проводится с использованием таких нестероидных противовоспалительных средств, как кромогликат или недокромил натрия, при тяжелом течении бронхиальной астмы необходимо использование ингаляционных кортикостероидов. Одна из причин распространенной фобии при назначении гормональных препаратов обусловлена бесконтрольным назначением препаратов системного действия, применение которых весьма ограничено. Ингаляционные кортикостероиды имеют существенные преимущества перед системными.
Лечение бронхиальной астмы у детей:
- базисная терапия
- Кромогликат натрия
- Недокромил натрия
- Ингаляционные и системные кортикостероиды
- Специфическая вакцинация аллергенами
Одновременно с
проведением базисной терапии у
больных бронхиальной астмой детей
осуществляется лечение других,
сопутствующих основному
заболеванию патологических
процессов. Осуществление
наблюдения за состоянием больного
и мониторинга проводимого лечения
с исследованием функции внешнего
дыхания позволяет в случае
необходимости своевременно
провести коррекцию назначенной
терапии.
Кромогликат натрия и недокромил
натрия занимают основное место в
лечении легкой и среднетяжелой
астмы у детей и менее эффективны
при тяжелом ее
течении.
Широкий спектр активности
препаратов этого класса
определяется способностью
ингибировать как раннюю фазу
аллергического ответа, так и
позднюю фазу аллергических реакций
при хроническом воспалении и
уменьшать бронхиальную
гиперреактивность.
Кромогликат натрия
принадлежит к широко используемым
фармакологическим средствам
лечения бронхиальной астмы у детей.
Необходим курс не менее 1,5-2 месяцев
по 1-2 ингаляции 3-4 раза в день.
Нежелание пациентов и врача ждать в
течение этого периода является
одной из главных причин, почему
антиаллергические препараты
рассматриваются как
“неэффективные”. Детям раннего
возраста возможны ингаляции
раствора препарата с помощью
небулайзера масочным способом. При
сохраняющихся приступах или
бронхообструкции, по данным
спирографии, эффективным может
быть назначение комбинированных
препаратов, в состав которых,
помимо кромогликата натрия, входят
симпатомиметики. Применение
кромогликата натрия способствует
урежению и более легкому течению
приступов бронхиальной астмы,
исчезновению ночных приступов,
препарат предупреждает
возникновение приступов
бронхиальной астмы при физическом
напряжении. Длительное применение
препарата позволяет поддерживать
устойчивую ремиссию болезни.
Недокромил натрия
представляется более специфичным
для лечения воспаления бронхов при
астме, тормозит высвобождение
медиаторов аллергии. Он ингибирует
высвобождение из воспалительных
клеток слизистой оболочки
дыхательных путей LTC4, PGD2, PAF,
хемотаксических факторов.
В исследованиях in vitro показана
ингибиция аккумуляции эозинофилов
в легких после провокаций
аллергенами, причем недокромил
натрия обладает приблизительно в 6-8
раз большей активностью, чем
кромогликат натрия. In vivo
кромогликат и недокромил натрия
уменьшают активацию эозинофилов,
нейтрофилов и макрофагов.
Недокромил натрия
предотвращает бронхоконстрикцию,
вызванную аллергеном, физическими
упражнениями, холодным воздухом,
диоксидом серы.
Продолжительное, не менее 2
месяцев, назначение ингаляций
недокромила натрия (по 2 ингаляции 2
раза в день) способствует снижению
бронхиальной гиперреактивности,
урежению приступов бронхиальной
астмы, более легкому их течению и
достижению клинической ремиссии
болезни. Этот препарат очень широко
применяется для лечения астмы у
детей. Наряду с дозированным
ингалятором применяются
ингаляторы со спейсером. У детей с
астмой использование только
кромогликата или недокромила
натрия может обеспечить терапию
астмы без потенциальных
опасностей, которые отмечаются при
применении b2-адреномиметиков,
кортикостероидов или теофиллинов.
Поэтому эти препараты особенно
полезны у детей на начальных этапах
заболевания.
Ингаляционные
кортикостероиды (ИКС).
Воспалительный процесс в бронхах
выявляется не только во время
обострения, но и в фазе ремиссии, в
связи с чем необходимым является
длительное применение
противовоспалительных препаратов
для профилактики обострений
бронхиальной астмы. Наиболее
мощным противовоспалительным
эффектом обладают кортикостероиды,
которые применяются как короткими
курсами при лечении обострений, так
и длительно при непрерывно
рецидивирующем течении астмы.
В клинической практике наиболее
показательным при лечении ИКС
является улучшение легочной
функции. Другие положительные
эффекты включают уменьшение
вариабельности показателей ФВД в
течение дня, а также потребности в
кортикостероидах per os, защиту от
бронхоконстрикции при контакте с
антигеном, при длительном
применении — снижение частоты
обострений и частоты
госпитализаций. Предполагается
влияние ингаляционных
кортикостероидов на снижение
смертности от астмы,
предотвращение изменений в легких,
ведущих к необратимой обструкции
дыхательных путей.
Современные ингаляционные
кортикостероиды (беклометазон,
будезонид, флунисолид, флутиказон)
оказывают минимальное общее
воздействие. Результаты
исследований свидетельствуют о
необходимости длительного
применения ингаляционных
кортикостероидов при тяжелом
течении (не менее 6-8 месяцев), однако
даже при длительной ремиссии после
отмены препарата возможно
возобновление симптомов
заболевания. Ингаляционные
кортикостероиды назначают после
ликвидации основных симптомов
острой дыхательной
недостаточности, восстановления
бронхиальной проходимости.
Ингаляционные кортикостероиды
имеют относительно медленное
начало действия — через несколько
дней, поэтому возможна комбинация в
начале лечения с парентеральным
или энтеральным введением
кортикостероидов и бронхолитиков
(пролонгированными теофиллинами и
симпатомиметиками).
При кратковременном назначении
ингаляционные кортикостероиды не
имеют очевидных побочных эффектов.
Менее чем у 5% пациентов отмечается
оральный кандидоз, несколько чаще
описана дисфония (20-30%). Длительное
назначение нередко ограничивается
опасением побочных эффектов в виде
системного воздействия на
организм.
В настоящее время не получено
клинически достоверных данных
депрессивного влияния ИКС на
гипоталамо-гипофизарно-надпочечниковую
систему у детей,которым проводят
эту терапию в течение нескольких
лет при использовании стандартных
(в педиатрии) доз (рис. 7-3).
Нет доказательств увеличения
риска катаракт у детей, частоты
инфекций, включая туберкулез, при
лечении ИКС. У маленьких детей,
лечившихся небулизированными
кортикостероидами, может
наблюдаться истончение кожи вокруг
рта.
Бронхорасширяющая терапия для
длительного применения.
При недостаточном эффекте
базисной противовоспалительной
терапии в комплекс терапии
добавляют пролонгированные
бронхолитики (теофиллины
длительного действия или
пролонгированные b2-агонисты) (рис. 7-4).
Теофиллины длительного
действия используют как в
комплексе противовоспалительной
терапии, так и для предупреждения
возникновения приступов
бронхиальной астмы, особенно
ночных.
| Средние дозы | Высокие дозы | |
| Беклометазон | 400-600 мкг* | > 600 мкг |
| Будезонид | 200-400 мкг | > 400 мкг |
| Флунисолид | 500-1000 мкг | > 1000 мкг |
| Флутиказон | 200-400 мкг* | > 400 мкг |
| Триамцинолона ацетонид | 800-1000 мкг | > 1000 мкг |
| *- У детей раннего возраста доза беклометазона составляет 200 - 300 мкг/сут, флутиказона - 100 - 200 мкг/сут. | ||
Оптимальной является доза теофиллина, обеспечивающая в сыворотке концентрацию,
равную 8-15 мкг/мл. Суточная доза пролонгированных теофиллинов
составляет 12-15 мг/кг массы тела, для больных с тяжелым течением
бронхиальной астмы она несколько ниже (11-12 мг/кг массы тела).
|
Международное название |
Суточная доза |
| b2-агонисты короткого действия | |
| Сальбутамол | 400 мкг |
| Тербуталин | 1000 мкг |
| Фенотерол | 400 мкг |
| b2-агонисты длительного действия | |
| Сальметерол | 100 мкг |
| Формотерол | 24 мкг |
Ингаляционные b2-агонисты длительного действия (сальметерол, формотерол) (рис. 7-4) обеспечивают бронходилатирующий эффект на протяжении 12 часов. Пролонгированные
b2-агонисты обычно назначают больным при наличии признаков недостаточной эффективности
проводимой противовоспалительной терапии. Их можно использовать
в целях сокращения числа возникающих приступов бронхиальной астмы
и, в частности, для предупреждения приступов, возникающих в вечерние
и ночные часы. Пероральные формы b2-агонистов длительного действия (например, вольмакс,
спиропент) в основном используются при нетяжелом течении бронхиальной
астмы.
Другая медикаментозная терапия.
Антилейкотриеновые препараты. В связи с доказанной ролью
лейкотриенов в формировании наиболее важных патогенетических звеньев
бронхиальной астмы возможно применение у детей с легкой и средней
тяжести астмой стало применение антилейкотриеновых препаратов,
которые представлены следующими двумя группами соединений: ингибиторы
синтеза (зилетон) и блокаторы рецепторов к лейкотриенам (зафирлукаст,
монтелукаст).
Кетотифен находит применение в лечении легкой и среднетяжелой
бронхиальной астмы у детей, особенно у детей раннего возраста
при сочетании бронхиальной астмы с кожной и/или гастроинтестинальной
аллергией.
Противоаллергический иммуноглобулин, гистаглобулин.
В настоящее время не рекомендуются большинством руководств в качестве
стандартного метода терапии БА.
Иммуностимуляторы бактериального происхождения (IRS-19,
бронхо-мунал, бронховакс, рибомунил и др.). Применение иммуностимулирующих
бактериальных препаратов снижает частоту интеркуррентных острых
респираторных заболеваний и обострений очагов хронической инфекции
и тем самым способствует урежению обострений бронхиальной астмы.
Не входят в число стандартных методов базисной терапии.
Специфическая аллерговакцинация.
Термин специфическая вакцинация аллергенами (“specific allergy
vaccination”) рекомендуется рабочей группой ВОЗ по Иммунотерапии
аллергенами в Женеве 1997 г., вместо терминов “гипосенсибилизация”
или “иммунотерапия”. Этот патогенетически обоснованный метод лечения
атопической бронхиальной астмы, поллиноза, аллергического риносинусита
и конъюнктивита заключается во введении больному нарастающих доз
одного или нескольких причинно-значимых аллергенов.
При бронхиальной астме у детей специфическая иммунотерапия
проводится аллергенами домашней пыли, Dermatophagoides pteronyssimus,
Dermatophagoides farinae, пыльцевыми, эпидермальными и грибковыми
аллергенами. Проведение специфической иммунотерапии показано детям
с атопической бронхиальной астмой легкого и среднетяжелого течения,
при четкой доказанности причинной значимости аллергенов, в случаях
малой эффективности проводимой фармакотерапии и невозможности
элиминировать причинно-значимые аллергены из окружающей больного
среды.
Для проведения специфической иммунотерапии, помимо общепринятого
парентерального апробируются эндоназальный, пероральный, сублингвальный
пути введения лечебных аллергенов. Продолжительность специфической
иммунотерапии составляет 3-4 года, более эффективна она в случаях
бронхиальной астмы, обусловленной моновалентной (особенно пыльцевой)
сенсибилизацией.
Проведение специфической гипосенсибилизации требует использования
стандартизованных экстрактов аллергенов тщательного мониторного
контроля в ходе лечения и квалификации специалиста.
7.4. ПРЕПАРАТЫ ДЛЯ ОКАЗАНИЯ ЭКСТРЕННОЙ ПОМОЩИ
Для снятия у больных бронхиальной астмой остро возникших
нарушений бронхиальной проходимости используют b2-агонисты короткого действия, антихолинергические
препараты, теофиллины короткого действия.
Предпочтение, по возможности, следует отдать ингаляционным
формам введения препаратов, позволяющим получить быстрый эффект
и уменьшить общее воздействие на организм ребенка (не распространяется
на теофиллин).
b2-агонисты короткого действия (сальбутамол, тербуталин, фенотерол) (рис. 7-4) при их ингаляционном применении дают быстрый, через 5-10 минут, бронходилатирующий
эффект. Препараты этого ряда могут использоваться для купирования
приступов бронхиальной астмы, для профилактики приступов удушья,
связанных с физическим напряжением. Ингаляционные b2-агонисты короткого действия назначаются не
более 4-х раз в день. С целью стабилизации состояния больных могут
проводиться короткие, до 7-10 дней, курсы лечения. При нетяжелых
приступах бронхиальной астмы можно использовать пероральные формы
b2-агонистов (сальбутамол, вентолин). Предпочтение
отдается эпизодическому назначению. При увеличении частоты использования
b2-агонистов более 3-4 раз в сутки необходим пересмотр
и усиление базисной терапии. При длительном бесконтрольном применении
b2-агонистов возможно усиление признаков бронхиальной
гиперреактивности.
Теофиллины короткого действия. При легких приступах бронхиальной
астмы назначение эуфиллина перорально может быть использовано
для купирования возникших нарушений бронхиальной проходимости.
В большинстве случаев он используется у больных бронхиальной астмой
после купирования приступа затрудненного дыхания ингаляционными
b2-агонистами для полного восстановления бронхиальной проходимости. Применяемая
парентерально средняя терапевтическая суточная доза эуфиллина:
у детей 3-14 лет составляет 10-15 мг/кг массы тела, а в возрасте
до 3-х лет — 5-10 мг/кг массы тела. При приеме эуфиллина внутрь
максимальная концентрация в плазме достигается примерно через
1 час. Период полувыведения — 4-5 часов. Поэтому подобный путь
введения целесообразно использовать при легких и умеренных приступах
удушья. У больных с тяжелым приступом бронхиальной астмы, резистентных
к терапии b2-агонистами, и при астматическом состоянии инфузионная
терапия эуфиллином является одним из основных компонентов в комплексе
проводимых лечебных мероприятий. Проводить ее необходимо в условиях
стационара, что связано с высокой частотой токсических эффектов.
Антихолинергические препараты. Ингаляционные антихолинергические
препараты (ипратропиум бромид, окситропиум бромид) могут использоваться
для купирования приступов бронхиальной астмы. Максимум бронходилатирующего эффекта развивается через 30 мин. после ингаляции.
У детей с первых месяцев жизни возможно использование ипратропиума
бромида через небулайзер. Сочетание с b2-агонистами (беродуал) обеспечивает синергический
эффект. Наиболее эффективны ингаляционные антихолинергические
препараты в случаях приступов, возникающих на фоне острой респираторной
вирусной инфекции, при воздействии ирритантов.
Лечение тяжелого приступа бронхиальной астмы
Терапия, проводимая при тяжелом приступе бронхиальной астмы,
включает мероприятия, направленные на устранение бронхоспазма,
уменьшение вазосекреторных расстройств, разжижение и удаление
мокроты, ликвидацию дыхательной и сердечной недостаточности, гипоксии,
метаболических нарушений и надпочечниковой недостаточности.
Оксигенотерапия начинается с момента поступления
проводится для поддержания адекватного уровня SаО2 (у детей более 95%). Кислород подается при помощи носовых канюль, маски или
кислородной палатки.
Регидратационная терапия необходима при развитии
дегидрации вследствие увеличения частоты дыхания и уменьшения
приема жидкости.
В качестве базисных растворов при проведении инфузионной терапии
используется изотонический раствор натрия хлорида и 5%-ный раствор
глюкозы (взятых поровну). Количество внутривенно вводимой жидкости
у детей раннего возраста , в зависимости от варианта приступного
периода, составляет 20-10 мл/кг массы, а общий объем — 150-300
мл; скорость введения 12-14 капель/мин, длительность инфузии (в
зависимости от объема) 3-6 часов.
b2-агонисты короткого действия являются основными начальными средствами купирования приступов удушья. Селективные b2-адреномиметики (сальбутамол, тербуталин, фенотерол)
(рис. 7-4) обеспечивают наиболее быстрое и выраженное расширение бронхов при минимальных
побочных эффектах. Начальное лечение предусматривает подачу одной
ингаляционной дозы каждые 20 минут в течение одного часа. Эффект
при использовании дозированных аэрозольных ингаляторов развивается
через 5-10 минут, длительность действия составляет 4-6 часов.
Ребенок с тяжелым приступом астмы имеет ограниченную способность
к ингаляции. Поэтому введение b2-агонистов должно осуществляться через небулайзер или спейсер.
При недостаточной эффективности ингаляционных b2-адреномиметиков в течение 1 часа дополнительно
может быть использовано парентеральное введение тербуталина, орципреналина,
или (при отсутствии видимого улучшения) адреналина (эпинефрина).
Действие адреналина, введенного подкожно или внутримышечно (в
малых и средних дозах), начинается через 15-20 минут и длится
1-2 часа.
Усиление бронхолитического действия b2-адреномиметиков может быть достигнуто и при комбинации с ингаляционными (через
небулайзер) антихолинергическими средствами (ипратропиум бромид
0,25 мг, детям первого года жизни — 0,125 мг), или пероральным
приемом эуфиллина.
Бесконтрольное применение этих средств или неправильная их
дозировка могут сопровождаться выраженными побочными явлениями:
тахикардией, экстрасистолией, артериальной гипертензией, головокружением,
бессонницей, беспокойством, гиперестезией, тремором рук.
Необходимо также учитывать возможность появления феномена десенситизации
b2-адренорецепторов бронхов (тахифилаксии) при длительном и бесконтрольном применении
адреностимуляторов. При астматическом состоянии, когда имеется
блокада b2-адренорецепторов, возникшая при многократном использовании симпатомиметиков,
указанные препараты не должны использоваться. Их применение в
этих случаях может привести к ухудшению состояния и даже летальным
исходам. Неэффективность введенного адреналина или наличие клинических
признаков блокады b2-адренорецепторов диктует необходимость парентерального
использования эуфиллина, кортикостероидов.
Теофиллины короткого действия (теофиллин, эуфиллин)
широко применяется при лечении больных, в том числе с наиболее
тяжелыми и опасными для жизни проявлениями бронхиальной астмы
(тяжелый приступ удушья, астматические состояния, асфиксический
синдром).
Нагрузочная доза составляет 4,5-5 мг/кг в течение 20-30 мин.
В последующем эуфиллин может вводиться в виде непрерывной инфузии
в дозе 0,6-1 мг/кг/ч или дробно в соответствующих дозах через
каждые 4-5 часов под контролем концентрации теофиллина в крови,
так как терапевтическая его концентрация колеблется в пределах
10-15 мкг/мл.
Побочные эффекты препаратов ксантинового ряда (тошнота, рвота,
тахикардия, аритмия, артериальная гипотония, гиперестезия, судороги,
остановка сердца) наблюдаются при передозировке препаратов.
Нельзя использовать пролонгированные препараты теофиллина
(теотард, теопек, ретафил, эуфилонг, теодур и др.) в терапии острых
приступов бронхиальной астмы!
Кортикостероидные гормоны занимают важнейшее
место в лечении тяжелой бронхиальной астмы.
Основные показания для назначения системных кортикостероидов
— наличие резистентности к терапии b2-агонистами и другими бронхоспазмолитиками,
развитие у больных выраженных признаков дыхательной недостаточности.
Системные кортикостероиды могут вводиться каждые 4-6 часов парентерально
(внутримышечно или внутривенно) до выведения из приступа или астматического
состояния. Альтернативный вариант лечения состоит в проведении
5-7 - дневного курса пероральной терапии системными кортикостероидами.
Препаратом выбора при купировании тяжелых астматических кризов
является преднизолон.
Применение кортикостероидов при астматическом состоянии следует
начинать на раннем этапе лечения ввиду их отсроченного действия
(в среднем 6 часов).
При лечении острого, тяжелого приступа астмы преднизолон может
быть назначен внутрь в дозе: детям до 1 года — 2 мг/кг/сут, 1
- 5 лет — 20 мг/сут, старше 5 лет — 20-60 мг/сут однократно или
коротким курсом 3-7 дней.
До стабилизации состояния доза препарата распределяется равномерно
в течение суток, в дальнейшем — с учетом циркадного ритма функции
коры надпочечников. При достижении полной клинической ремиссии
постепенную отмену преднизолона начинают с уменьшения вечерней
дозы, добавления ингаляционных кортикостероидов и постепенного
перевода на терапию ИКС. Следует помнить, что форсированное уменьшение
дозы кортикостероидов или полная их отмена без учета состояния
ребенка является одной из основных причин развития асфиксического
синдрома.
Алгоритм вышеуказанных средств в приступном периоде бронхиальной
астмы у детей представлен на рис. 7-5.
Другие виды лечения
В исключительных случаях при отсутствии эффекта от терапии
может возникнуть необходимость применения поднаркозной бронхоскопии.
При наличии инфекционно-воспалительных изменений в бронхолегочной
системе назначается антибиотикотерапия по общим принципам.
Назначение ингаляционных муколитических препаратов в период
тяжелых обострений бронхиальной астмы может усилить кашель и обструкцию
дыхательных путей.
Следует избегать назначения седативной терапии при обострении
астмы, поскольку бензодиазепины и снотворные препараты угнетают
дыхание.
В педиатрической практике, по возможности, следует отдавать
предпочтение неинвазивным процедурам, чтобы не причинять боль
и не вызывать у ребенка тревогу.
Возникновение тяжелого обострения указывает на необходимость
пересмотра текущего и перспективного планов медикаментозного лечения.
Показания для госпитализации детей, больных бронхиальной астмой
При обострении бронхиальной астмы у детей
направление на стационарное лечение показано при следующих ситуациях:
- невозможность или неэффективность (в течение 1-3 часов) проведения
лечения в домашних условиях;
- выраженная тяжесть состояния больного;
- детям из группы высокого риска осложнений и по социальным
показаниям;
- при необходимости установления природы и подбора средств
терапии впервые возникших приступов удушья.

7.5. СТУПЕНЧАТЫЙ ПОДХОД К ТЕРАПИИ БРОНХИАЛЬНОЙ АСТМЫ У ДЕТЕЙ
Противорецидивная
терапия при бронхиальной астме у
детей направлена на достижение и
поддержание устойчивой ремиссии,
при этом ее тактика определяется
тяжестью течения болезни. Основу
противорецидивного лечения
составляет противовоспалительная
терапия.
У детей с легким течением
бронхиальной астмы
противорецидивная терапия
проводится кромогликатом или
недокромилом натрия. В случае
возникновения приступов
бронхиальной астмы назначают
эпизодически ингаляционные b2-агонисты.
У больных с неустойчивым по
бронхиальной астме состоянием
эффективным может оказаться
временное использование
комбинированных препаратов (интал
плюс, дитэк) с последующим
переходом на терапию кромогликатом
или недокромилом натрия.
У детей с бронхиальной астмой
среднетяжелого течения лечение
начинают с назначения кромогликата
или недокромила натрия и
подключения, в случае
возникновения приступа, b2-агонистов.
В случаях возникновения ночных
приступов бронхиальной астмы
проводимая терапия может быть
дополнена назначением
пролонгированных теофиллинов или
симпатомиметиков. В случаях, когда
проводимая таким образом терапия
оказывается неэффективной,
присоединяют лечение
ингаляционными кортикостероидами
(беклометазон в суточной дозе до
400-600 мкг или другие ингаляционные
кортикостероиды в эквивалентных
дозах).
У детей с тяжелым течением
бронхиальной астмы комплекс
терапевтических мероприятий
включает ингаляционные
кортикостероиды (в высоких дозах),
нередко в комбинации с
ингаляционными пролонгированными b2-агонистами
или препаратами теофиллина
длительного действия,
антихолинергическими препаратами.
Перорально кортикостероиды
назначают в случае неэффективности
ингаляционных форм. В течение 5-7
дней назначают преднизолон в
суточной дозе 1-2 мг/кг, затем
проводится снижение дозы
преднизолона и постепенная его
отмена с переходом на ИКС.
При стабилизации состояния
больных доза ингаляционных
кортикостероидов у детей может
быть уменьшена, а при наличии
устойчивой ремиссии в течение 6-12
мес. они могут быть полностью
отменены. В этом случае больного
переводят на терапию меньшей
ступени, т.е.назначают кромогликат
или недокромил натрия. Больным с
тяжелым или
среднетяжелым течением
бронхиальной астмы в случае
нестабильности состояния могут
проводиться повторные курсы или
непрерывное лечение
ингаляционными кортикостероидами.
Контроль за течением и
профилактика обострений пыльцевой
бронхиальной астмы в период
цветения причинно-значимых
растений осуществляется
назначением кромогликата или
недокромила натрия, а также
проведением антимедиаторной
терапии (например, кетотифен). При
этом терапию назначают за 2-3 недели
до предполагаемого обострения.
В период ремиссии бронхиальной
астмы детям с легким и
среднетяжелым ее течением при
наличии показаний и условий
проводится специфическая
вакцинация аллергенами,
позволяющая достичь устойчивой и
длительной ремиссии болезни (рис.
7-6).
Особенности лечения детей раннего возраста
Бронхиальная
астма у детей до 1 года встречается
чаще, чем диагностируется. У многих
больных раннего возраста
возникновению астмы предшествует
атопический дерматит. Достижению
ремиссии болезни у детей первых лет
жизни, страдающих бронхиальной
астмой, способствует соблюдение
гипоаллергенного режима, лечение
кетотифеном, ингаляционная терапия
раствором кромогликата натрия,
недокромила натрия после 2 лет
масочным способом. В случаях
обострения бронхиальной астмы
используют b2-агонисты,
доставляемые с помощью
дозированного аэрозоля через
спейсер, с использованием лицевой
маски или распылителя,
антихолинергические препараты,
метилксантины.
В случаях тяжелого течения
бронхиальной астмы у детей раннего
возраста достичь ремиссии болезни
помогает лечение ингаляционными
кортикостероидами с помощью
дозированного аэрозоля через
спейсер. В качестве распыляемого
кортикостероида у детей раннего
возраста может использоваться
беклометазон, флутиказон.
7.6. ИНГАЛЯЦИОННАЯ ТЕХНИКА У ДЕТЕЙ*
Аэрозольное
лечение широко используется в
современной терапии бронхиальной
астмы у детей, что определяется
быстрой доставкой препарата в
дыхательные пути, местной
активностью, уменьшением системных
побочных эффектов. Практически
большинство бронхолитиков,
ингаляционных кортикостероидов,
кромогликат и недокромил натрия
попадают в организм ребенка с
помощью ингаляции. Обучение детей с
бронхиальной астмой и их родителей
правильной технике использования
ингаляционных препаратов
исключительно важно.
Наиболее широкое
распространение получили
дозирующие баллонные ингаляторы,
из которых препарат подается под
давлением. Около 30% взрослых и 70-70%
детей имеют трудности при
использовании препаратов в этих
формах. Плохая ингаляционная
техника оказывает влияние на дозу,
попадающую в легкие, и,
следовательно, на ответную реакцию.
При наличии трудностей в
использовании ингаляторов
лекарство не приносит улучшения
или облегчения, что приводит к
прекращению приема препарата.
При использовании
дозированного ингалятора
требуется синхронизация между
нажатием на баллончик, который
выбрасывает аэрозоль, и вдохом
ребенка. Технические ошибки,
наблюдаемые в ингаляционной
технике, включают нажатие
баллончика перед вдохом, в конце
вдоха, во время выдоха,
множественные нажатия во время
ингаляции, отсутствие задержки
дыхания в конце ингаляции,
недостаточное встряхивание
баллончика и т.д.
При недостаточной координации
меньшее количество препарата может
поступать в легкие, однако в этом
случае при лечении ингаляционными
кортикостероидами побочный эффект
может возрастать вследствие
большего попадания лекарства в
полость рта и глотки.
Важный момент в ингаляции из
дозированного ингалятора —
задержка дыхания в конце вдоха. Эта
пауза дает дополнительное время
осаждению частиц на поверхности
дыхательных путей.
У детей возможно применение
ингаляции с широко открытым ртом
наряду с обычной техникой, т.е.
когда пациент плотно охватывает
ртом ингалятор. Ингалятор
располагается приблизительно на 4
см перед широко открытым ртом. При
этом по сравнению с обычной
ингаляционной техникой различия не
существенны.
Улучшает технику ингаляции
СПЕЙСЕР. Клапанные спейсеры
представляют собой камеры,
удерживающие аэрозоль и
ограничивающие необходимость
координации вдоха с нажатием
ингалятора. Использование спейсера
не исключает, однако, необходимости
правильной ингаляционной техники.
Общее поступление препарата в
легкие сходное или более высокое
при использовании спейсера по
сравнению с только правильной
дозированной ингаляцией.
Сухие порошкообразные
ингаляторы (дискхалеры) —
альтернативная система,
позволяющия доставлять
лекарственные вещества в
дыхательные пути пациентов путем
инициации дыханием.
АУТОХАЛЕР. Это приспособление
автоматически производит
ингаляцию при вдохе. Таким образом,
отпадает необходимость в
синхронизации дыхания.
У детей раннего возраста или
больных, имеющих сложности в
использовании дозированных
ингаляторов, применяются растворы
или суспензии с помощью
небулайзера (распыления жидких
препаратов с помощью компрессора).
Инструкции по
использованию различных
дозирующих устройств показана на
рисунках 7-7 - 7-13.
СТУПЕНЧАТЫЙ ПОДХОД К БАЗИСНОМУ (ДЛИТЕЛЬНОМУ) ЛЕЧЕНИЮ БРОНХИАЛЬНОЙ АСТМЫ У ДЕТЕЙ
Ступень 1 |
Ступень 2 |
Ступень 3 |
|
Легкое течение |
Среднетяжелое течение |
Тяжелое течение |
|
Базисная терапия (направлена на предотвращение развития приступов) |
|||
| Противо-воспа-лительная терапия (пато-геническая терапия) | Кромгликат натрия 4 раза в сут. или недокромил натрия 2 раза в сут. |
Кромгликат
натрия 4 раза в сут. или
недокромил натрия 2-4 раза в
сут. |
Ингаляционные
кортикостероиды* |
| Бронхо-расширяющая терапия для длительного применения (назначается одновременно с противо-воспа-лительной) | Не показана |
Теофиллин пролонгированного действия или b2-агонисты пролонгированного действия** |
Теофиллин пролонгированного действия или b2-агонисты пролонгированного действия** |
Симптоматическое лечение (бронходилататоры для быстрого купирования симтомов) |
|||
| Бронхо-расширяющая терапия для быстрого купирования приступа | Эпизодически: |
Ингаляционные
b2-агонисты
короткого действия** |
Ингаляционные
b2-агонисты
короткого действия** |
| *См. таблицу
суточных доз ингаляционных
стероидов **См. таблицу основных препаратов группы b2-агонистов |
|||
КОММЕНТАРИИ
- Предпочтителен ингаляционный путь введения медикаментозных препаратов при помощи дозированных аэрозолей, порошковых ингаляторов (по возможности, с использованием спейсеров), а также небулайзеров.
- При астме легкого течения с редкими приступами и длительной ремиссией базисная терапия кромогликатом натрия или недокромилом натрия проводится для профилактики сезонных обострений.
- Прием кромогликата натрия или недокромила натрия с профилактической целью показан также при постнагрузочном бронхоспазме или контакте с аллергеном.
- b2-агонисты пролонгированного действия (сальметерол, формотерол) используются в комбинации с противовоспалительными препаратами при их недостаточной эффективности.
- При легком течении атопической астмы у детей раннего возраста и в случаях сочетанных проявлений бронхиальной астмы и атопического дерматита также может быть рекомендован кетотифен.
- По завершении курса лечения стероидами per os необходим переход на ингаляционные стероиды.
- При отсутствии выраженных клинико-функциональных проявлений заболевания у детей с тяжелой астмой в течение 6 месяцев возможно снижение суточной дозы ингаляционных стероидов с их постепенной заменой на недокромил натрия или кромогликат натрия.
- Детям с легким и среднетяжелым течением бронхиальной астмы в период клинической ремиссии при наличии показаний возможно проведение специфической аллерговакцинации (САВ) специалистом, подготовленным в этой области.
7.7. НЕМЕДИКАМЕНТОЗНЫЕ МЕТОДЫ ЛЕЧЕНИЯ БРОНХИАЛЬНОЙ АСТМЫ У ДЕТЕЙ
Возможности
немедикаментозной терапии у
больных бронхиальной астмой очень
велики и в настоящее время
используются недостаточно.
Лечащий врач должен
внимательно отнестись к эффекту от
немедикаментозного лечения
больного. Нужно попытаться
заменить “впечатление” больного и
членов его семьи показателями
объективного мониторирования
симптомов и пикфлоуметрией. Здесь
принципиальным является умение
убедить больного в сотрудничестве
и отсутствии предвзятого мнения со
стороны врача.
Потенциально опасным является
отказ от стандартной терапии в
пользу немедикаментозных
нетрадиционных методов, с чем часто
приходится
сталкиваться на практике.
Важным положением является
возможность сочетания
нетрадиционных методов со
стандартными схемами
медикаментозного лечения, т.к. сами
по себе немедикаментозные методы
лечения бронхиальной астмы не
получили должной верификации в
контролируемых исследованиях.
Применяя их, прежде всего
необходимо учитывать безопасность,
безвредность и неинвазивность
метода, проводить его в условиях
мониторинга за состоянием больного
и под контролем врача или опытного
методиста.
ГЛАВА VIII
СОЦИАЛЬНЫЕ АСПЕКТЫ
8.1. РАСХОДЫ НА ЛЕЧЕНИЕ БРОНХИАЛЬНОЙ АСТМЫ
Закономерности в распределении заболевания свидетельствуют о том, что около 20% в структуре болезни приходится соответственно на тяжелую и средней тяжести бронхиальную астму и около 60% — на легкую. Мобилизация финансовых ресурсов имеет свои закономерности: более 60% средств приходится на лечение тяжелых форм, большая часть из оставшихся 40% приходится на лечение бронхиальной астмы средней тяжести. Таким образом, больные с легкой астмой не вовлекаются в профилактические программы, как наиболее эффективные в достижении высокого качества жизни больного. Становится понятным важность выявления болезни на ранних ее этапах. Это положение является одним из центральных в стратегии лечения и профилактике заболевания. С нарастанием тяжести болезни увеличивается и вероятность ятрогенных эффектов вследствие полипрагмазии. Все возрастающий удельный вес приходится на непрямые расходы, где основное место занимают образовательные программы. Экономической части придается важное значение в национальных программах по борьбе с астмой. Первые исследования, выполненные в России по прямым расходам на лечение больного с бронхиальной астмой, свидетельствуют о большом затратном механизме. Индивидуальные и государственные средства преимущественно тратятся на приобретение лекарственных средств.
8.2. ИНВАЛИДНОСТЬ ПРИ БРОНХИАЛЬНОЙ АСТМЕ У ДЕТЕЙ
Бронхиальная
астма — наиболее частая причина
инвалидности при хронических
неспецифических заболеваниях
легких у детей и составляет 70% от
общего числа детей с инвалидностью
вследствие хронических
заболеваний легких.
Тяжелая бронхиальная астма
является причиной значительных
ограничений жизнедеятельности,
снижения социальной активности
больных детей, т.е. снижения их
качества жизни. Частые пропуски
занятий в школе, ограничение
социальной и физической активности
отрицательно сказываются на
развитии ребенка, вызывают
существенные трудности у родителей
больного.
По существующим в нашей стране
нормативным документам
инвалидность устанавливается у
детей, больных тяжелой
бронхиальной астмой.
При прогнозируемой возможности
полного или частичного
восстановления нарушенных функций,
вариантов с обратным развитием
заболевания, исходом в полную
ремиссию при тяжелом течении
бронхиальной астмы назначается
инвалидность на 2 года, с
последующим
переосвидетельствованием. При
гормонозависимой бронхиальной
астме в связи с тяжестью течения, на
долгие годы требующего постоянного
медикаментозного лечения и
наблюдения; неуклонным
прогрессирующим течением, а также
отсутствием эффективных методов
лечения, возможностью
неблагоприятного прогноза,
инвалидность сразу
устанавливается на срок до
достижения 16 лет.
Инвалидность означает
необходимость предоставления
социальной защиты или помощи
ребенку. Временная инвалидность
является этапом реабилитации и
восстановления социальной
полноценности с использованием
комплекса медицинских,
педагогических, психологических
мероприятий; при длительном
назначении позволяет оказывать
всестороннюю социальную поддержку
общества.
В Москве и С.-Петербурге
инвалидность определена у 7% из
числа официально
зарегистрированных детей с
диагнозом бронхиальной астмы.
Можно с уверенностью утверждать,
что реальное число детей-инвалидов
вследствие бронхиальной астмы
значительно превышает данные
официальной статистики и ежегодно
увеличивается.
Бронхиальная астма, начавшаяся
в детском возрасте, является
причиной инвалидизации и взрослого
населения. У 40-50% взрослых инвалидов
вследствие бронхиальной астмы
заболевание началось в детском
возрасте.
Создание системы реабилитации
детей-инвалидов вследствие
бронхиальной астмы является
насущной задачей. При этом, наряду с
решением вопросов медицинского
наблюдения, пристальное внимание
должно быть обращено на решение
социальных и психологических
проблем этих больных.
Реабилитационные воздействия
должны начинаться как можно раньше.
Психологическая реабилитация
является неотъемлемой частью общих
реабилитационных мероприятий у
детей-инвалидов вследствие
бронхиальной астмы.
ГЛАВА IX
ОБРАЗОВАТЕЛЬНЫЕ ПРОГРАММЫ
Ключевыми моментами для родителей детей, страдающих бронхиальной
астмой, являются:
- не ограничивать ребенка в активности и занятиях физической
культурой и спортом;
- регулярное мониторирование пиковой скорости выдоха для контроля
эффективности лечения и ранней диагностики ухудшения состояния;
- понимание критериев обращения за неотложной медицинской помощью;
- приобретение навыков неотложной помощи. Международный
консенсус первой и важнейшей задачей программы по успешному лечению
бронхиальной астмы предусматривает просвещение и обучение пациентов
по различным вопросам астмы.
Эффективность терапии бронхиальной астмы у детей тесно связана
с тщательным выполнением родителями квалифицированных врачебных
рекомендаций. Недостаточная осведомленность родителей об основных
этиологических факторах, лежащих в основе развития и обострений
бронхиальной астмы, а также о существующих современных методах
лечения приводит к тому, что многие из них игнорируют назначения
врачей, самостоятельно прекращают лечение или пользуются услугами
неспециалистов.
Образование является необходимой составной частью комплексной
программы лечения детей с бронхиальной астмой. Создание российских
образовательных программ относится к числу центральных разделов
национальной программы, актуальность которой значительно возрастает
в период недостаточного финансирования здравоохранения
Одной из лучших и эффективных форм обучения родителей являются
систематические занятия в астма-школе.
Основной целью педиатрической астма-школы является повышение
эффективности терапии бронхиальной астмы у детей и контроль за
течением болезни у них посредством образования родителей ребенка
или самого пациента-подростка. В ходе этих занятий семья больного
ребенка или подросток получают необходимую информацию о причинах
развития и основах патогенеза бронхиальной астмы, об основных
принципах противорецидивной, противовоспалительной и бронхолитической
терапии.
В основу астма-школы заложены следующие концептуальные положения:
1) здоровье пациента может быть восстановлено только при обеспечении
здорового образа жизни; 2) психологическая реабилитация должна
предшествовать физической; 3) необходимы знания основ фармакотерапии
и самоконтроля; 4) семья — главный этап реабилитации больного.
Введение этих принципов позволяет снизить частоту обострения бронхиальной
астмы у детей в 2,8 раза.
Составлению программы должно предшествовать анкетирование родителей
с целью определения их исходного уровня знаний.
В астма-школе родители убеждаются, что они не одиноки, что
рядом с ними такие же страждущие, что им хотят помочь врачи и
ученые-специалисты, и все они объединены одним желанием — избавить
детей от тяжелых симптомов астмы, научить управлять болезнью.
Партнерские отношения должны включать постоянную оценку симптомов
болезни и возможность регулярно получать консультативную помощь.
Особого такта и выдержки необходимо придерживаться при обучении
подростков, когда они входят в пубертатный период, и течение астмы
во многом зависит от адекватности их поведения и систематичного
лечения.
Возможно, имеет смысл создание астма-клубов для подростков
в виде переходного этапа от астма-школы в детской практике к астма-школе
взрослых.
Необходимо подчеркнуть более высокую эффективность лечения
при условии образования как всей семьи, так и врача, постоянно
наблюдающего за ребенком, страдающим бронхиальной астмой.
В больнице дети, страдающие бронхиальной астмой различной степени
тяжести в приступном периоде, в астматическом состоянии, нуждаются
в постоянном врачебном контроле. Задача этого этапа программы
состоит в подборе индивидуальной схемы медикаментозного лечения
с доступным для детей и родителей разъяснением целесообразности
того или иного вида терапии, в выборе врачом немедикаментозного
метода лечения больного.
Образование пациентов и родителей на этом этапе включает:
1 - получение элементарных сведений об анатомии, физиологии
дыхания, сущности их заболевания; принципы лекарственной терапии,
необходимость противовоспалительной терапии; принципы аллергодиагностики.
2 - обучение детей самоконтролю состояния, оценке симптомов
болезни с помощью пикфлоуметров, подсчету пульса, частоты дыхания,
контрольной паузы, ведению дневника;
3 - обучение дыхательным методикам по методу биологически обратной
связи или волевого управления дыханием в зависимости от возраста,
тяжести заболевания, психологических особенностей пациента;
4 - обучение общей релаксации, элементам аутотренинга, самомассажу
биологически активных точек (БАТ) для активного использования
в приступном периоде наряду с дыхательной гимнастикой;
5 - обучение родителей оценке соматического состояния ребенка,
правильной трактовке проявлений заболевания;
6 - обучение родителей необходимым навыкам экстренной помощи
(медикаментозное лечение, устранение неблагоприятных факторов,
водный режим, классический массаж и массаж биологически активных
точек, дыхательная гимнастика, психотерапевтические приемы; обращение
к врачу);
7 - беседы с родителями пациента об особенностях его психологического статуса (тестирование проводится по проективным методикам-рисункам,
тестам на память и внимание); выяснение психологического климата
в семье; овладение приемами оценки психического состояния ребенка
и возможной его коррекции;
8 - обучение родителей контролю за состоянием ребенка и выполнением
рекомендаций врача в межприступном периоде, во время ремиссии.
Практика свидетельствует, что при осуществлении образовательных
программ снижается:
- количество приступов астмы;
- частота обращений за медицинской помощью;
- количество пропусков школьных занятий;
- количество листов нетрудоспособности у родителей в связи
с уходом за больными детьми;
- бронхолабильность дыхательных путей;
- число госпитализаций.
Образовательные программы не ограничены только отношением врач
- родители (врач - пациент). В педиатрии система межличностных
контактов значительно раздвигает границы и может быть обозначена
как:
- родители - ребенок;
- ребенок - сверстники;
- ребенок - воспитатель, учитель;
- ребенок - медицинский персонал;
- ребенок - взрослые.
Обучение всех, кто окружает больного ребенка, их сотрудничество
на всех этапах позволяет улучшить течение, оптимизировать прогноз
заболевания, снизить процент инвалидизации и повысить качество
жизни детей, страдающих бронхиальной астмой.
Представляется целесообразным создание республиканских (городских)
детских астма-центров, позволяющих проводить комплексные согласованные
лечебно-профилактические мероприятия в конкретных условиях, обеспечить
продолжительное наблюдение за больными (от грудного до подросткового
возраста); уменьшить финансовые затраты на дублирующие друг друга
медицинские службы и подразделения.
В задачи астма-центра входит:
- разработка теоретических основ стратегии ведения больных
бронхиальной астмой детей;
- определение основных принципов лечения в данном регионе;
- проведение углубленной диагностики (в том числе аллергологической);
- консультация больных детей, коррекция проводимого лечения;
- создание астма-школ для больных детей и их родителей;
- определение показаний для обследования и лечения у смежных
специалистов;
- определение целесообразности применения различных немедикаментозных
методов лечения;
- специализация и повышение квалификации врачей по астмологии.
Консультации специалистов по бронхиальной астме рационально
проводить именно в условиях подобных центров.
Отдельного внимания заслуживает решение вопросов социальной
адаптации детей, страдающих бронхиальной астмой. В этом
плане индивидуальный подход к реабилитации больного ребенка должен
предусматривать наблюдение психолога, консультации социальных
работников (изменение жилищно-бытовых условий и т.п.).
В функцию психолога - специалиста по бронхиальной астме входит:
- разработка форм и методов работы с больным и его семьей;
- проведение циклов индивидуальных или групповых занятий с
больным и его семьей;
- планирование посещений психолога больным и его семьей.
Больной может планировать посещение психолога самостоятельно
Одной из важных мер социальной адаптации является своевременная
профессиональная ориентация детей, больных бронхиальной астмой,
с участием школьного врача, педагогов и родителей.
ОБРАЗОВАНИЕ ПРИ БРОНХИАЛЬНОЙ АСТМЕ
Комплекс социальных, педагогических, медицинских мероприятий, направленных
на повышение качества жизни больных.
Для эффективного ОБРАЗОВАНИЯ необходимо:
-Наличие образованных врачей, медсестер, причастных к вопросам
астмы.
-Методическое обеспечение ( печатная продукция, видео, средства
массовой информации, телефон помощи).
-Возможность контроля течения болезни использованием пикфлоуметрови
аппаратов для оценки фвд.
-Наличие широкого спектра противоастматических препаратов и
средств доставки (спейсеров, небулайзеров).
-Сотрудничество пациента и врача(комплайнс)
ЦЕЛЬ ОБРАЗОВАНИЯ |
|
| ВРАЧЕЙ | -Повышение
качества профессиональной
подготовки по вопросам
бронхиальной астмы. -Достижение преемственности в ведении больных на разных этапах болезни. |
| МЕДСЕСТЕР | -Приобретение
навыков ведения больных в
партнерстве с врачом. -Обучение методическим приемам образования больных. |
| ОРГАНИЗАТОРОВ ЗДРАВООХРАНЕНИЯ | Информирование
об: -эпидемиологических аспектах, -социальной значимости астмы, -стоимости лечения
астмы |
| ОКРУЖЕНИЯ БОЛЬНОГО | -Обучение
оказанию неотложной помощи, -умению ориентироваться в психологических, правовых, социальных проблемах больного. |
ОБРАЗОВАНИЕ БОЛЬНОГО РЕБЕНКА И ЕГО РОДИТЕЛЕЙ
ЦЕЛЬ:
Приобретение знаний о заболевании, навыков самопомощи, ориентации в различных ситуациях, психологическая коррекция для успешного контроля над симптомами астмы и повышения качества жизни.
СОТРУДНИЧЕСТВО (КОМПЛАЙНС) — ГЛАВНЫЙ АСПЕКТ УСПЕШНОГО КОНТРОЛЯ АСТМЫ
СОТРУДНИЧЕСТВО — это соглашение, достигнутое между врачом, медицинской сестрой и пациентом, о том, какие действия необходимо предпринимать для лечения астмы или в особых ситуациях. Соглашение представлено в виде плана самоведения.
Принципы обучения больных детей и родителей:
-здоровый
образ жизни;
-знание причин формирования
астмы у ребенка;
-выделение управляемых
факторов риска формирования и
обострения астмы;
-клинико-функциональный
самоконтроль за течением
астмы;
-динамическое наблюдение у
специалиста.
Родителей и детей
старшего возраста
необходимо обучить:
-правилам пользования
пикфлоуметром;
-систематическому ведению
записей его значений;
-определению уровня опасных
и безопасных показателей
пикфлоуметра (система цветовых
“зон”);
-немедленному извещению
врача в случае опасного уровня
показателя.
АСТМА-ШКОЛА
Это форма образования пациентов и их родителей, включающая циклы лекций и практических занятий, необходимых для повышения уровня знаний о болезни, приобретения навыков самопомощи и самоконтроля, психологической коррекции поведения больного и членов семьи.
Программа
подготовки в астма-школе
должна включать следующую
БАЗИСНУЮ ИНФОРМАЦИЮ:
-Сведения об анатомии,
физиологии дыхания, сущности
заболевания.
-Информацию о триггерах,
факторах риска, методах
профилактики.
-Симптомы обострения,
приступа, тактику оказания
помощи при приступе.
-Обучение пользованию
пикфлоуметром для оценки
симптомов болезни.
-Сведения о медикаментозной
терапии.
-Обучение навыкам
пользования ингаляторами.
-Обучение подростков
навыкам самоконтроля и оценки
состояния по системе цветовых
“зон”.
-Обсуждение планов
длительного ведения больного.
АСТМА-ЦЕНТР
(городской, областной,
республиканский)
ЗАДАЧИ:
-Адаптация национальных
рекомендаций к локальным
условиям.
-Проведение углубленной
диагностики (в том числе
функциональной,
аллергологической) и
консультации у смежных
специалистов.
-Диспансеризация больных.
-Образование при
бронхиальной астме.
-Помощь в организации
больных.
-Пропаганда стратегии
борьбы с бронхиальной астмой.
-Сотрудничество с
фармацевтическими структурами
для обеспечения больных
высокоэффективными
противоастматическими
препаратами.
ДЛИТЕЛЬНЫЙ
КОНТРОЛЬ ЗА АСТМОЙ: |
СОВЕРШЕНСТВУЮЩИЙ ЭТАП Формирование
астма-клубов. |
РАЗВИВАЮЩИЙ ЭТАП Адресное образование с гибким
формированием многочисленных
групп. |
БАЗИСНЫЙ ЭТАП Формирование
групп. |
